
【题目】下列变化必需加入还原剂才能实现的是
A.KMnO4→MnO2B.Cl2→NaClC.FeCl3→FeCl2D.CO→CO2
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】工业用氧化铝与焦炭在氮气流中加强热制备氮化铝(AlN),氮化铝样品中含少量Al4C3、C、Al2O3杂质。某实验小组拟测定ag氮化铝样品中Al4C3含量并探究甲烷与氧化铜反应的氧化产物为CO2。
已知:(Ⅰ)AlN、Al4C3都能与水反应,分别生成NH3、CH4。
(Ⅱ)CH4还原氧化铜:CH4+4CuO![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。
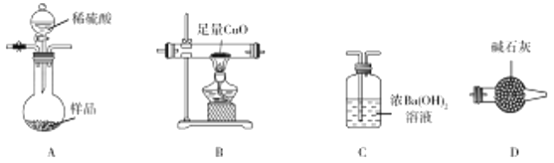
(1)装置连接顺序为 ________________________(按气流从左至右)。
(2)写出A中发生反应的化学方程式:AlN和稀硫酸反应:__________________________;Al4C3与
稀硫酸反应:_______________________________________________________________________。
(3)有下列操作步骤:
①缓缓向A中通入一定量的N2。
②称量B(酒精灯、木块和铁架台除外),按顺序组装仪器,检查装置的气密性,将样品放入烧瓶中;
③点燃B处酒精灯;
④再次称量B;
⑤从分液漏斗中缓慢滴入稀硫酸,直到不再产生气体为止;
⑥再次缓慢通入一定量的N2。
正确的操作顺序是_________________________;操作①的目的是_______________;若操作③与操作⑤顺序颠倒, 将导致测得的Al4C3的质量分数_________(填“偏大”“偏小”或“不变”)。
(4)设计实验证明A中有NH4+生成:__________________________________。
(5)实验结束后,测得B中固体质量减少bg,则样品中Al4C3的质量分数为________×100%。
(6)通过测定C中生成BaCO3的质量可以确定甲烷与氧化铜反应是否有CO生成。实验完毕后,测得B
中固体质量减少bg;对C中混合物进行过滤、洗涤、干燥、称重,当m(BaCO3)=________g时(用含b表达式表示),表明氧化产物只有CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2 ![]() 2NO+O2 , 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 , 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2 , 同时生成2n mol NO2;
②单位时间内生成n mol O2 , 同时生成2n mol NO;
③NO2、NO、O2的浓度比为2:2:1;
④混合气体的压强不再改变;
⑤混合气体的颜色不再改变;
⑥混合气体的平均摩尔质量不再改变.
A.①④⑤⑥
B.①②③⑤
C.②③④⑥
D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为
(2)a、b、c三点处,电离程度最大的是
(3)表是几种常见弱酸的电离平衡常数(25℃):
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOHCH3COO﹣+H | K=1.76×10﹣5 |
H2CO3 | H2CO3H++HCO3﹣H2CO3﹣H++HCO32﹣ | K1=4.31×10﹣7K2=5.61×10﹣11 |
HClO | HClOH++ClO﹣ | K=3.0×10﹣8 |
CH3COOH、H2CO3、HClO,其中酸性最强的是 , 最弱的是
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4
②NH3H2O . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
【答案】 二 ⅥA 5 弱 硫原子半径大于氧原子半径,硫原子和氧原子的最外层电子数相等,硫原子的得电子能力比氧原子弱 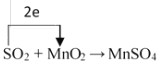 在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
【解析】试题分析:(1)氧原子核外有2个电子层,最外层有6个电子,硫原子核外电子排布式是1S22S22P63S23P4;(2)同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,锰元素化合价由+4降低为+2;(4)氧气能把二氧化硫氧化为 H2SO4;二氧化硫污染空气,用氢氧化钙能吸收二氧化硫;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,根据化合价升降相同计算物质的量之比。
解析:(1)氧原子核外有2个电子层,最外层有6个电子,所以氧元素在元素周期表中位于第二周期ⅥA族,硫原子核外电子排布式是1S22S22P63S23P4,有5个能级,所以有5种能量不同的电子;(2) 同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,所以S非金属性比O弱;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,硫失去2个电子,锰元素化合价由+4降低为+2,锰元素得到2个电子,所以电子转移方向和数目是 ;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
点睛:氧化还原反应中,氧化剂得电子化合价降低,还原剂失电子化合价升高,根据氧化还原反应的升降规律,氧化剂得电子数一定等于还原剂失电子数。
【题型】综合题
【结束】
22
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。

(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究氯气的性质,设计如图所示装置进行实验,装置田中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。

(1)加入药品前,检查I中气体发生装置气密性的操作是:用止水夹夹住C处______________。
(2)装置I中生成氧气的离子方程式为________________。
(3)装置II的作用是________________。
(4)实验过程中,装置IV中的实验现象为________________。
(5)实验过程中,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象,其原因是________________。为达到该预期现象,应改进实验装置,改进的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是

A. Z、N两种元素的离子半径相比,前者较大
B. X、N两种元素的气态氢化物的沸点相比,前者较低
C. 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两个热化学方程式中,△H1 和△H2的相对大小正确的是( ) S(s)+O2(g)=SO2(g)△H1; S(g)+O2(g)=SO2(g)△H2 .
A.△H1>△H2
B.△H1<△H2
C.△H1﹦△H2
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A. Ba2+、Na+、NO3-、SO42-B. Mg2+、Cl-、Al3+、SO42-
C. K+、Cl-、CO32-、NO3-D. Ca2+、Na+、Fe3+、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com