
| A. | 原子序数d>c>b>a | B. | 离子半径C2->D->B+>A2+ | ||
| C. | 原子半径A>B>C>D | D. | 非金属性:C>D |
分析 短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,原子序数:a>b>d>c,可推知A为Mg,B为Na,C为O,D为F.
A.由a-2=b-1=c+2=d+1,则原子序数:a>b>d>c;
B.电子层结构相同,核电荷数越大离子半径越小;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,
D.由同周期从左向右元素的非金属性增强.
解答 解:短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,原子序数:a>b>d>c,可推知A为Mg,B为Na,C为O,D为F.
A.由a-2=b-1=c+2=d+1,则原子序数:a>b>d>c,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,故离子半径C2->D->B+>A2+,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:B>A>C>D,故C错误;
D.由同周期从左向右元素的非金属性增强,则非金属性:F>O,即非金属性:D>C,故D错误,
故选B.
点评 本题考查位置结构性质的相互关系及应用,清楚元素周期律的递变规律是解答该题的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 1 mol NH4CI 固体中共价键总数为5NA | |
| B. | 16g O2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1 mol N2,充分反应后得2NA 个氨分子 | |
| D. | 18g水(H2O)含有8NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,铝和铂都不能与浓硝酸发生反应 | |
| B. | 氯气和硫酸铁都可以用于处理生活用水 | |
| C. | 加热I2和NH4Cl晶体,最后都无固体残留 | |
| D. | SO2气体和Na2SO3溶液都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | ①将一小块金属钠放入滴有酚酞溶液的冷水中 ②将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. ③将一小段镁带投入稀盐酸中 ④将一小片铝投入稀盐酸中 |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
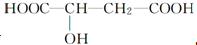 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| D. | HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 L苯所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| B. | 1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,22.4 LC2H4的质量为28克 | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
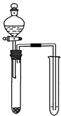 | 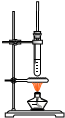 |  |  |
| A.证明酸性: 醋酸>碳酸>苯酚 | B.制备乙酸丁酯 | C.苯萃取碘水中I2,分出水层后的操作 | D.用NH4Cl饱和溶液制备NH4Cl晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com