
| A、PM2.5作为空气质量预报的一项重要指标,它是指空气中直径大于或等于2.5μm的颗粒物,该值越高,代表空气污染程度越严重 |
| B、最近天津市对小轿车进行“双限”措施,这种做法是防止酸雨的途径之一,也是减少雾霾的途径之一 |
| C、镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗 |
| D、工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 |


科目:高中化学 来源: 题型:
 依据某氧化还原反应设计的原电池如图所示.
依据某氧化还原反应设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的氢硫酸溶液中含有的H2S分子数为NA |
| B、将1molNa2CO3溶于1L 水后,所得溶液中含有CO32-离子数为NA |
| C、电解NaCl溶液时,阳极上析出22.4L氯气,转移电子数为2NA |
| D、pH=13的1.0 L Ba(OH)2溶液中含有的OH-数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1装置模拟铁的吸氧腐蚀 |
| B、图2装置制取并吸收NH3 |
| C、图3装置量取8.5mL的稀硫酸 |
| D、图4装置制取少量乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ | ||
| 浓度mol/L | 0.1 | 0.5 | 0.9 | 1 | 1 |
| 电离度% | 0.3 | 0.15 | 0.1 | 0.3 | 10 |
| A、HX>HY>HZ |
| B、HZ>HX>HY |
| C、HY>HZ>HX |
| D、HZ>HY>HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
实验目的 | 温度/℃ | 催化剂 质量/g |
反应物初始浓度 /10-3mol?L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下两个实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 0 | 7 | 9 | |
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |
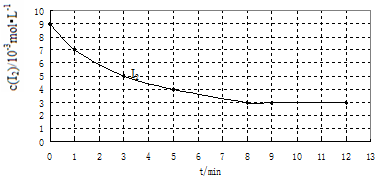
查看答案和解析>>
科目:高中化学 来源: 题型:
 图中A为淡黄色固体,B、C为液体,D为气体,E、F为白色沉淀.
图中A为淡黄色固体,B、C为液体,D为气体,E、F为白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
| A、该反应正反应为放热反应 |
| B、起始浓度不变,K越大,反应物的转化率越大 |
| C、温度不变,增加X的用量,K增大 |
| D、达平衡后,加入催化剂,K增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com