
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |


科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| W | 单质为密度最小的气体 |
| X | 元素最高正价与最低负价之和为0 |
| Y | 工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z | 存在质量数为23,中子数为12的核素 |
| T | 金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
查看答案和解析>>
科目:高中化学 来源:2014届甘肃省高三上学期期中考试理综化学试(解析版) 题型:填空题
X、Y、Z、T、W五种元素的性质或原子结构如下表:
|
元素 |
元素性质或原子结构 |
|
X |
原子的最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
|
T |
与Z同周期,元素最高价是+7价 |
|
W |
原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______;W元素基态原子电子排布式
为______________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________________。
A.常温下Z的单质和T的单质状态不同
B. T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D. T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为______,它所形成的晶体类型为______; Y的常见氢化物易液化的主要原因是________________________。
(4)元素X与钙元素可以形成一种离子化合物,该化合物的阴离子和CO互为等电子体,该化合物的电子式为 ;其中元素X的杂化类型是 。
查看答案和解析>>
科目:高中化学 来源:2014届安徽省江南十校新高三摸底联考化学试卷(解析版) 题型:填空题
下表给出了五种元素的相关信息,其中w、X、Y、Z为短周期元素,原子序数依次递增。
|
元素 |
相关信息 |
|
W |
单质为密度最小的气体 |
|
X |
元素最高正价与最低负价之和为0 |
|
Y |
工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
|
Z |
存在质量数为23,中子数为12的核素 |
|
T |
金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
根据上述信息填空:
(1)元素Y在元素周期表中的位置是 。XY2由固态变为气态所需克服的微粒间作用力是 。
(2)化合物甲是一种强氧化剂,由元素Y和Z组成,写出甲的化学式: ,
(3)化合物乙由元素W和X组成,乙是同时含极性共价键和非极性共价键的相对分子质量最小的分子。在25℃、101kpa下,已知2g的气体乙在Y2气体中完全燃烧后恢复至原状态,放热QkJ,该燃烧反应的热化学方程式是 。
(4)化合物丙仅由W、X、Y、Z、T中的四种元素组成,四种元素的质量比为1:6:40:64,化合物丙中含有两种阴离子,写出燃烧丙的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省合肥市高三第三次教学质量检测理综化学试卷(解析版) 题型:推断题
X、Y、Z、T、W五种元素的性质或原子结构如下表:
|
元素 |
元素性质或原子结构 |
|
X |
原子的最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
|
Z |
基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
|
T |
与Z同周期,元素最高价是+7价 |
|
W |
原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
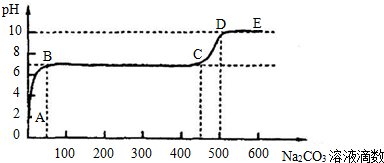
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化 曲线如下图所示:

请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com