
【题目】工业上利用脱硫后的天然气合成氨的某流程如下:
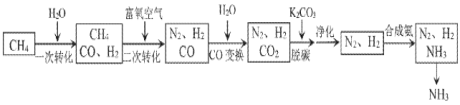
(1)“一次转化”中H2O(g)过量的目的是______。
(2)已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(g)△H=-484kJmol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJmol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJmol-1
“二次转化”时CH4和O2反应生成CO和H2的热化学方程式为______。
(3)“CO变换”的反应是CO(g)+H2O(g)CO2(g)+H2(g)某温度下,该反应的平衡常数K=1,若要使CO的转化率达到90%,则起始时c(H2O):c(CO)应不低于______。
(4)“脱碳”后的溶液再生的方法是______(以化学方程式表示)。
(5)“净化”时发生的反应为 [Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)[Cu(NH3)3CO]Ac(aq),△H<0。充分吸收CO采取的措施是______(选填序号)。
a 升温b 降温c 加压d 减压
(6)已知N2(g)+3H2(g)2NH3(g)△H<0,平衡时NH3的物质的量分数c(NH3)与氢氮比x(H2与N2的物质的量比)的关系如图:
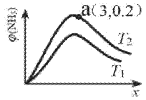
①T1______T2(填“>”、“=”或“<”)。
②a点总压为50Mpa,T2时Kp=______(Mpa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③实验测得一定条件下合成氨反应的速率方程为v=kc(N2)c1.5(H2)c-1(NH3)。以下措施既能加快反应速率,又能提高H2平衡转化率的是______
a 加压b 使用催化剂c 增大氢氮比d 分离NH3
【答案】增大CH4的平衡转化率 2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70kJmol-1 9:1 KHCO3![]() K2CO3+CO2↑+H2O bc > 3.7×10-4 ad
K2CO3+CO2↑+H2O bc > 3.7×10-4 ad
【解析】
(1)增大反应物浓度,平衡正向移动,提高另一原料的利用率或平衡转化率;
(2)依据盖斯定律计算;
(3)由题给条件建立如下三段式计算;
(4)“脱碳”原料为K2CO3,“脱碳”后的溶液为KHCO3或KHCO3、K2CO3混合溶液;
(5)反应[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)[Cu(NH3)3CO]Ac(aq)正向是体积减小的反应;
(6)①分析反应图象可知,平衡后,其它条件相同时,T2温度下生成物NH3的体积分数大于T1,而合成氨反应正向放热;
②由题给条件建立如下三段式计算;
③压缩气体增大压强、增大c(N2)等既能加快反应速率,又能提高H2平衡转化率;催化剂只加快反应速率,不改变反应进程,平衡不移动;增大氢氮比,相当增大c(H2),反应正向进行;
(1)增大反应物浓度,平衡正向移动,提高另一原料的利用率或平衡转化率,所以“一次转化”中H2O(g)过量的目的是增大CH4的平衡转化率,故答案为:增大CH4的平衡转化率;
(2)已知反应①2H2(g)+O2(g)=2H2O(g)△H=-484kJmol-1②2CO(g)+O2(g)=2CO2(g)△H=-566kJmol-1③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJmol-1,由盖斯定律③×2-②-①×2有CH4和O2反应生成CO和H2的热化学方程式为2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=(-802kJmol-1)×2-(-566kJmol-1)-(-484kJmol-1)×2=-70kJmol-1,故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70kJmol-1;
(3)设起始时c(H2O)=a,c(CO)=1mol/L,由题给条件建立如下三段式:
CO(g)+H2O(g)CO2(g)+H2(g)
起始浓度(mol/L) 1 a 0 0
变化浓度(mol/L) 0.9 0.9 0.9 0.9
平衡浓度(mol/L) 0.1a-0.9 0.9 0.9
则平衡常数K=![]() =
=![]() =1,解得a=9mol/L,所以CO的转化率达到90%,起始时c(H2O):c(CO)≥9:1,故答案为:9:1;
=1,解得a=9mol/L,所以CO的转化率达到90%,起始时c(H2O):c(CO)≥9:1,故答案为:9:1;
(4)“脱碳”原料为K2CO3,“脱碳”后的溶液为KHCO3或KHCO3、K2CO3混合溶液,KHCO3对热不稳定,加热可转化为K2CO3重复使用,反应的化学方程式为KHCO3![]() K2CO3+CO2↑+H2O,故答案为:KHCO3
K2CO3+CO2↑+H2O,故答案为:KHCO3![]() K2CO3+CO2↑+H2O;
K2CO3+CO2↑+H2O;
(5)反应[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)[Cu(NH3)3CO]Ac(aq)正向是体积减小的反应,增大压强、降低温度均可使反应正向进行提高CO的利用率,bc正确,故答案为:bc;
(6)①分析反应图象可知,平衡后,其它条件相同时,T2温度下生成物NH3的体积分数大于T1,而合成氨反应正向放热,达到平衡后,升高温度时平衡逆向进行、氨气的体积分数降低,并且温度越高、氨气的体积分数越小,所以T1>T2,故答案为:>;
②a点坐标为(3,0.2),设n(N2)=1mol,则n(H2)=3mol,反应的三段式为
N2(g)+3H2(g)2NH3(g)
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x3-3x2x
NH3的体积分数=![]() =0.2,解得x=
=0.2,解得x=![]() ,p(N2)=
,p(N2)=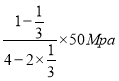 =10Mpa,p(H2)=30Mpa,p(NH3)=10Mpa,压强平衡常数Kp=
=10Mpa,p(H2)=30Mpa,p(NH3)=10Mpa,压强平衡常数Kp=![]() =
=![]() =
=![]() (Mpa)-2=3.7×10-4(Mpa)-2,故答案为:3.7×10-4;
(Mpa)-2=3.7×10-4(Mpa)-2,故答案为:3.7×10-4;
③压缩气体增大压强、增大c(N2)等既能加快反应速率,又能提高H2平衡转化率,结合速率方程可知c(NH3)越小,反应速率越大,并且分离氨气,平衡正向移动可提高;催化剂只加快反应速率,不改变反应进程,不能提高H2平衡转化率;增大氢氮比,相当增大c(H2),反应正向进行,但H2平衡转化率降低,所以既能加快反应速率,又能提高H2平衡转化率的措施为ac,故答案为:ac。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)X的化学名称为__________。
(2)B单质的结构式为__________;E的气态氢化物的电子式为__________;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为______________,该物质属于______________(填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是__________(写化学式)。
(4)D是同周期简单阳离子中离子半径最__________(填“大”或“小”)的元素。
(5)F的单质在反应中常作________剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,图为两套实验装置。
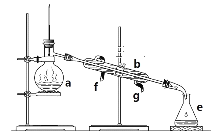
(1)写出下列仪器的名称:
a.__________________
b.__________________
(2)若利用装置I分离四氯化碳和酒精的混合物还缺少的仪器是__________,将仪器补充完整后进行实验。冷凝水由________(填f或g)口通入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、![]() 、
、![]() 、
、![]() 等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
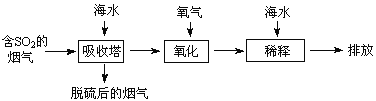
下列说法错误的是
A.海水pH约为8的原因主要是天然海水含![]() 、
、![]()
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将![]() 、SO32-、H2SO3氧化为
、SO32-、H2SO3氧化为![]()
D.经稀释“排放”出的废水中,![]() 浓度与海水相同
浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
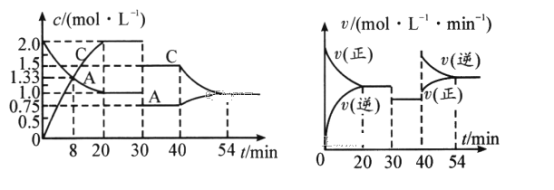
(1)0~20min,A的平均反应速率为__mol/(L·min);8min时,v正__v逆(填“>”“=”或“<”)。
(2)反应方程式中的x=__,30min时改变的反应条件是__。
(3)20~30min时反应的平衡常数__(填“>”“=”或“<”)3040min时反应的平衡常数。
(4)该反应的正反应为__(填“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是_min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两个容积相同的密闭容器,甲容器中充入N2和CO的混合气体,乙容器中充入O2,当它们的温度和密度都相同时,下列说法中正确的是
A.两容器中气体的压强相等
B.甲容器中气体的平均摩尔质量与乙容器中气体的摩尔质量相等
C.甲乙两容器气体的质量相等
D.甲乙两容器气体所含原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A. 0.1 mol L1的盐酸15 mL B. 0.2 mol L1的盐酸12 mL
C. 0.15 mol L1的硫酸溶液8 mL D. 18 mol L1的浓硫酸15 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com