
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 平衡后再加入1molSO3,SO2的转化率增大 |
分析 A.为可逆反应,不能完全转化;
B.增大压强,正逆反应速率均增大;
C.物质的量越大,压强越大,平衡正向进行的趋势越大;
D.平衡后再加入1molSO3,压强增大.
解答 解:A.为可逆反应,不能完全转化,则2体积SO2和足量O2反应,一定不能生成2体积SO3,故A正确;
B.增大压强,正逆反应速率均增大,平衡正向移动,且正反应速率大于逆反应速率,故B正确;
C.物质的量越大,压强越大,平衡正向进行的趋势越大,则加入2molSO2和1molO2放出的热量大于加入1molSO2和0.5molO2放出热量的2倍,故C错误;
D.平衡后再加入1molSO3,压强增大,平衡正向移动,SO2的转化率增大,故D正确;
故选C.
点评 本题考查化学平衡的移动,为高频考点,把握压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意可逆反应不能完全转化及选项C为解答的难点,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:实验题
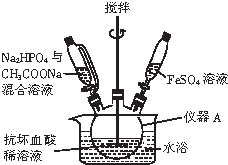 磷酸亚铁晶体[Fe3(PO4)2•8H2O]是蓝白色单斜晶体,溶于稀强酸,不溶于水、醋酸、醇,主要用于制作磷酸铁锉电池.实验室制备磷酸亚铁晶体的装置、反应原理和实验步骤如下:
磷酸亚铁晶体[Fe3(PO4)2•8H2O]是蓝白色单斜晶体,溶于稀强酸,不溶于水、醋酸、醇,主要用于制作磷酸铁锉电池.实验室制备磷酸亚铁晶体的装置、反应原理和实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
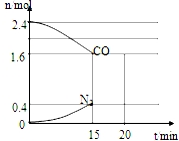 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.4 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5517.6 kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-48.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
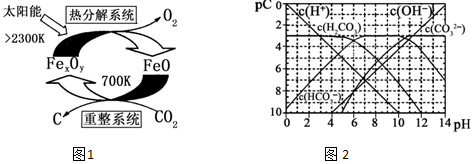
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
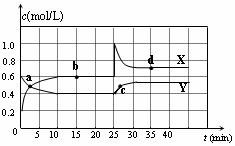
| A. | 图中的两条曲线,X表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)=0.02 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L | |
| D. | 该温度下反应的平衡常数 K=1.11 L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液有漂白和消毒作用 | |
| B. | 工业中将氯气通入石灰乳中制取漂白粉 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 漂白粉在空气中久置失效 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com