
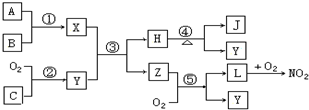
分析 Z与氧气反应得到L与Y,L与氧气反应得到NO2,则Z为NH3、L为NO、Y为H2O,氧气与单质C反应得到水,则C为H2,B在空气中燃烧得到J和少量X,而A与B反应得到X,X与水反应得到氨气与H,则X为氮化物,H为氢氧化物,加热H得到J与水,可推知A为N2,B为Mg,X为Mg3N2,H为Mg(OH)2,J为MgO,据此解答.
解答 解:Z与氧气反应得到L与Y,L与氧气反应得到NO2,则Z为NH3、L为NO、Y为H2O,氧气与单质C反应得到水,则C为H2,B在空气中燃烧得到J和少量X,而A与B反应得到X,X与水反应得到氨气与H,则X为氮化物,H为氢氧化物,加热H得到J与水,可推知A为N2,B为Mg,X为Mg3N2,H为Mg(OH)2,J为MgO.
(1)单质A是N2,单质C是H2,化合物Z是NH3,故答案为:N2;H2;NH3;
(2)反应①化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,
反应③化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
反应⑤化学方程式为:4NH3+5 O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;4NH3+5 O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查无机物推断,化合物Z与氧气连续反应生成二氧化氮为推断突破口,再结合转化化学进行推断,需要学生熟练掌握元素化合物性质,基本属于猜测验证型题目,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{100W}{36a}$×100% | B. | $\frac{W}{36a+W}$×100% | C. | $\frac{W}{3600a+W}$×100% | D. | $\frac{100W}{36a+W}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量最小的化合物分子式是CH2O | |
| B. | 相对分子质量最小的化合物分子式是C2H2O | |
| C. | 含相同碳原子数的各化合物,其相对分子质量之差是16的整数倍 | |
| D. | 含相同碳原子数的各化合物,其相对分子质量之差是18的整数倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
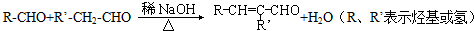
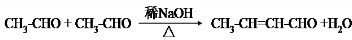 .
.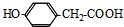 .
.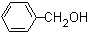 和乙醛为起始原料(其他无机试剂可任选),制备
和乙醛为起始原料(其他无机试剂可任选),制备 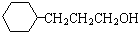 的合成路线,合成路线流程图示例如下:
的合成路线,合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂或缩小容器体积,该平衡均不会移动 | |
| B. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 该可逆反应达平衡后,放出a kJ的热能(假设化学能全转化为热能) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com