
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 0 | 50 | 120 | 232 | 290 | 310 |
| ||
| △t |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、明矾能起催化剂作用 |
| B、明矾更易使碳酸氢钠发生分解反应 |
| C、明矾受热分解放出气体 |
| D、明矾在水中能起到酸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
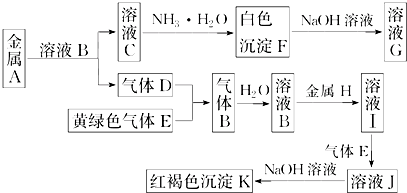
查看答案和解析>>
科目:高中化学 来源: 题型:
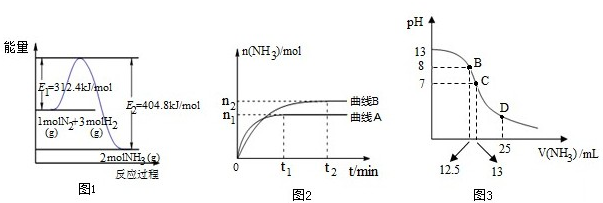
| n1 |
| 4t1 |
| 7 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6:3:2 |
| B、3:2:1 |
| C、1:2:3 |
| D、1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com