
分析 (1)求出100mL质量分数为20%,密度为1.71g/mL的Al2(SO4)3溶液中Al2(SO4)3的质量,继而能求出物质的量,然后根据1molAl2(SO4)3中含3molSO42-来计算SO42-、Al3+的物质的量和个数;溶液是均一稳定的,和所取的溶液的体积无关;根据稀释前后溶质的物质的量不变来分析.
(2)氧气和臭氧均由氧原子构成;分子个数之比等于物质的量之比;在同温同压下,气体的体积之比等于物质的量之比;混合气体的平均摩尔质量$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$;气体的密度之比等于相对分子质量之比;
(3)1.01×105Pa,273K时,气体摩尔体积是22.4L/mol,根据M=ρVm计算该气体的摩尔质量,据此计算X的相对原子质量.
解答 解:(1)100mL质量分数为20%,密度为1.71g/mL的Al2(SO4)3溶液中Al2(SO4)3的质量m=100mL×1.71g/mL×20%=34.2g,故Al2(SO4)3的物质的量n=$\frac{34.2g}{342g/mol}$=0.1mol,而1molAl2(SO4)3中含3molSO42-和2molAl3+,故0.1molAl2(SO4)3中含0.3molSO42-和0.2molAl3+,即含0.3NA个SO42-离子;由于溶液是均一稳定的,和所取的溶液的体积无关,故80mL溶液中c(Al3+)=$\frac{0.2mol}{0.1L}$=2mol/L;设稀释至100mL后硫酸根的浓度变为xmol/L,根据稀释前后溶质的物质的量不变可知:3mol/L×80mL=xmol/L×100mL.解得x=2.4mol/L.故答案为:0.3NA;0.2mol;2mol/L;2.4mol/L;
(2)氧气和臭氧均由氧原子构成,3mol O2与2mol O3中均含6mol氧原子,故原子个数之比为1:1,则质量之比为1:1;分子个数之比等于物质的量之比,由于物质的量之比为3:2,故分子个数之比为3;2;在同温同压下,气体的体积之比等于物质的量之比,故体积之比为3:2;混合气体的平均摩尔质量$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$=$\frac{32g/mol×3mol+48g/mol×2mol}{5mol}$=38.4g/mol;由于气体的密度之比等于相对分子质量之比,故混合气体的密度与氢气的相对密度为38.4:2=19.2,
故答案为:1:1;3:2;1:1;3:2;38.4g/mol;19.2;
(3)在273K时,气体摩尔体积是22.4L/mol,即Vm=22.4 L•mol-1,Xn的相对分子质量为22.4d,X的相对原子质量是$\frac{22.4d}{n}$,
故答案为:$\frac{22.4d}{n}$.
点评 本题考查常用化学计量的有关计算,为高频考点,侧重对基础知识的巩固运用,注意把握相关计算公式的运用,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用品: 有效成分:NaCl用途:做调味品 有效成分:NaCl用途:做调味品 | |
| B. | 用品: 有效成分:Na2CO3用途:做发酵粉 有效成分:Na2CO3用途:做发酵粉 | |
| C. | 用品: 有效成分:Al(OH)3用途:做抗酸药 有效成分:Al(OH)3用途:做抗酸药 | |
| D. | 用品: 有效成分:Ca(ClO)2用途:做消毒剂 有效成分:Ca(ClO)2用途:做消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3mol电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁与三氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| B. | 氯化铝溶液中加入过量的氨水Al3++4NH3•H2O=4NH4++AlO2-+2H2O | |
| C. | Fe(OH)3跟盐酸反应:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 钠和冷水反应:Na+2H2O=Na++H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、CO32-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向银氨溶液中加入足量氢溴酸溶液:Ag(NH3)2++OHˉ+3H+═Ag++2NH4++H2O | |
| B. | 向0.1 mol/L pH=1的NaHA的溶液中加入NaOH溶液:HA-+OH-═H2O+A2- | |
| C. | H2C2O4使酸性KMnO4溶液褪色:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:2Ba2++2SO42-+4OH-+Al3+═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
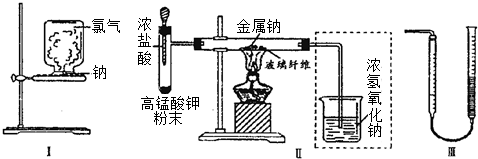
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可用于治疗胃酸过多,作胃酸中和剂 | |
| B. | 氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 | |
| C. | 碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去 | |
| D. | 质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
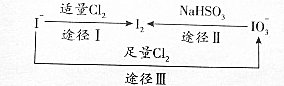 碘在地壳中主要以NaIO3的形式存在.在海水中主要以I-的形式存在.几种粒子之间有如图转化关系,根据如图转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在.在海水中主要以I-的形式存在.几种粒子之间有如图转化关系,根据如图转化关系推测下列说法不正确的是( )| A. | 可用KI-淀粉试纸和食醋检验加碘盐中是否含有碘 | |
| B. | 在碘水中通入Cl2,发生反应的化学方程为5Cl2+I2+6H2O=2HIO3+10HCI | |
| C. | 由图可知氧化性的强弱顺序为Cl2>I2>IO3 | |
| D. | 途径Ⅲ中,若消耗1moICl2,反应中转移的电子为2moI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com