
| A. | 溶液pH不断增大,最后为7 | B. | 阳极先析出Cl2,后析出O2 | ||
| C. | 阴极始终只析出H2 | D. | 电解最后阶段为电解水 |
分析 某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为5:2,则n(Cl-):n(H+)=5:4,相当于溶液中溶质为HCl、NaCl、Na2SO4,且其物质的量之比为4:1:2,根据电解产物,可分为三个阶段,三个阶段电池反应式分别为2HCl$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑、2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,
据此分析解答.
解答 解:某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为5:2,则n(Cl-):n(H+)=5:4,相当于溶液中溶质为HCl、NaCl、Na2SO4,且其物质的量之比为4:1:2,根据电解产物,可分为三个阶段,三个阶段电池反应式分别为2HCl$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑、2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,
A.根据以上分析知,电解过程中导致c(OH-)增大,溶液的pH增大,但最终溶液中溶质为硫酸钠和NaOH,溶液呈碱性,pH>7,故A错误;
B.氯离子放电能力大于氢氧根离子,所以先生成氯气,后生成氧气,故B正确;
C.钠离子放电能力小于氢离子,所以阴极上只有氢气生成,故C正确;
D.第一阶段电解HCl、第二阶段电解氯化钠和水、第三阶段电解水,故D正确;
故选A.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,明确各个阶段发生的反应是解本题关键,注意根据原子守恒等量代换确定溶液中溶质成分,题目难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯(C4H6)分别在空气中充分燃烧,所耗用氧气的量依次增大 | |
| C. |  的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 用新制氢氧化铜悬浊液不能鉴别乙醇溶液和葡萄糖溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,甲基橙呈红色的溶液中:Na+、NH4+、SO42-、CH3COO- | |
| B. | 滴入酚酞试液显红色的溶液:Na+、Ba2+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=1×10-13mol/L的溶液:NH4+、K+、CO32-、Cl- | |
| D. | 含有大量HCO3-的溶液:K+、Al3+、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
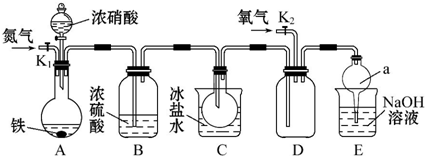
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 基态Fe原子的外围电子排布图为 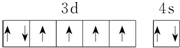 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,在Fe元素周期表中位于ds区 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
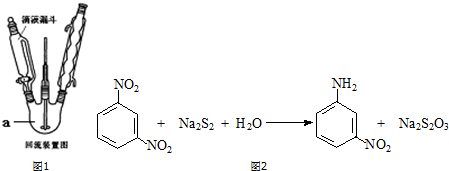
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com