
【题目】将铝片和铜片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为( )
A.铜片、铝片B.铝片、铜片C.铝片、铝片D.铜片、铜片
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生下列反应,其中属于盐类水解反应的是
A. NH4+ + 2H2O![]() NH3·H2O + H3O+ B. HCO3-+H2O
NH3·H2O + H3O+ B. HCO3-+H2O![]() H3O+ + CO32-
H3O+ + CO32-
C. HS- + H3O+ ![]() H2S + H2O D. Cl2 + H2O
H2S + H2O D. Cl2 + H2O ![]() H+ + Cl- + HClO
H+ + Cl- + HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种常用的植物调味油,可按如下路线合成:
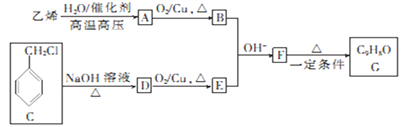
已知:![]()
回答下列问题:
(1)下列关于乙烯的说法不正确的是_________(填字母)。
a.分子中所有原子共平面
b.能发生氧化反应,不能发生还原反应
c.能发生加聚反应生成高分子
d.能使酸性高锰酸钾溶液褪色
(2)由F生成G的反应类型为_________________________。
(3)C中官能团的名称为___________,由C生成D的反应类型为___________。
(4)D的化学名称为___________,由D生成E的化学方程式为___________。
(5)苯环上含有两个取代基,且分子中含有酯基的F的同分异构体有_________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是__________(填结构简式)。
(6)参照上述合成路线,设计以B为原料(无极试剂任选)制备高吸水性树脂![]() 的合成路线:________________。
的合成路线:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的图解表示构成生物体的元素、化合物及其作用,其中a、b、d、e代表小分子,A、B、E、F代表不同的分子量较大的物质,请据图回答下列问题:
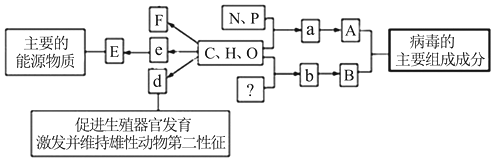
(1)e是细胞中主要的能源物质,被人称为“生命的燃料”,则e是___,E在植物细胞中主要是指_________,E在人体中主要分布于 ______ 细胞。
(2)在HIV(人类免疫缺陷病毒)中物质A的中文名称是___________,其基本组成单位a有______种。
(3)物质d是______;物质F是______,并且由于其储存能量多而且所占体积小,是生物体内重要的储能物质。等质量的物质F与物质E相比,物质F储存的能量多,从元素的含量上看,原因是 _____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中所含氢原子个数与3.2g O2 所含的分子数相同的是( )
A. 0.2gNH3 B. 0.1mol HCl分子
C. 6.02×1023个H2SO4分子 D. 标准状况下1.12L CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____________________________________。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤______(选填①、②、③、⑤)。
(3)滤渣2的主要成分为_______________________________。
(4)写出步骤④后产生滤渣3的离子反应方程式______________________________。
(5)滤液3中含碳粒子浓度大小的顺序为______________________________________。
Ⅱ.BaS溶液的制备:
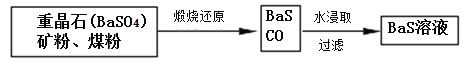
(6)写出煅烧还原的化学反应方程式__________________________________。
BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶___________________。
Ⅲ.制取锌钡白:
(7)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
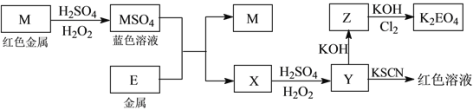
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:_______________________________。
(2)检验X中阳离子的方法和现象是__________________________________________________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:_______________________________、____________________________________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有________、________、 __________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
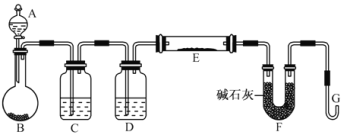
①仪器B中应装入___________,装置D的作用_________________________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
___________________________在这两步之间还应进行的操作是_________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com