
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
分析 A.离子晶体中可能存在共价键;
B.原子晶体中原子间通过共价键结合形成空间网状晶体,稀有气体晶体属于分子晶体;
C.NaHSO4、NaOH晶体中的阴、阳离子个数比均为为1:1;
D.一般来说,晶体熔点高低顺序是:原子晶体>离子晶体>分子晶体,含有氢键的物质熔沸点升高.
解答 解:A.离子晶体中可能存在共价键,如KOH,故A错误;
B.原子晶体中原子间通过共价键结合形成空间网状晶体,所以原子晶体中只有共价键,稀有气体晶体属于分子晶体,故B正确;
C.NaHSO4中含有钠离子和硫酸氢根离子,NaOH中含有钠离子和氢氧根离子,晶体中的阴、阳离子个数比均为1:1,故C错误;
D.一般来说,晶体熔点高低顺序是:原子晶体>离子晶体>分子晶体,含有氢键的物质熔沸点升高,水中含有氢键,所以晶体熔点高低顺序为金刚石>食盐>冰>干冰,故D错误;
故选B.
点评 本题考查物质性质、结构,明确物质的构成微粒是解本题关键,侧重于基础知识的考查,题目难度不大,注意稀有气体为单原子分子没有共价键.


科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列化学反应中,属于氧化还原反应的是
A.NaOH+HCl=NaCl+H2O B.NH3+HCl=NH4Cl
C.2FeC12+Cl2=2FeC13 D.H2CO3=H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有4种不同的伸展方向 | B. | 有5种不同能量的电子 | ||
| C. | 有5种不同的运动范围 | D. | 有14种不同运动状态的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增加FeS2的量 | B. | 增大O2的浓度 | C. | 升高温度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
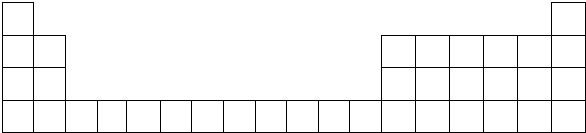
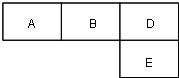 M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.
M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.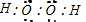 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | NaH的存在能支持可将氢元素放在ⅦA的观点 | |
| D. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
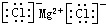 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com