
 Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:| 1 |
| 3 |


科目:高中化学 来源: 题型:
| A、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C、将氯气溶于NaOH溶液制备漂白粉:Cl2+2OH-=H2O+Cl-+ClO- |
| D、用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 催化剂 |

| 高温高压 |
| 催化剂 |
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol?L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g?L-1) | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
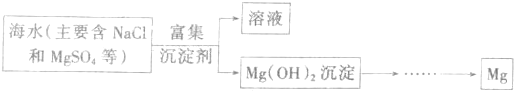
| 观点 | 是否正确 | 简述理由 |
| 学生1 | 否 | |
| 学生2 | ||
| 学生3 |
| △ |
| 电解 |
| 2800℃ |
| △ |
| C真空 |
| 1352℃ |
| ①过量盐酸 |
| ②△ |
| 电解 |
| 714℃ |
| 盐酸 |
| 活泼金属 |
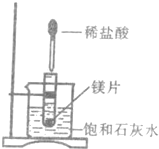
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgX2 |
| B、Mg2X5 |
| C、Mg2X3 |
| D、Mg3X2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com