
【题目】煤化工中两个重要反应为: ①C(s)+H2O(g)═H2(g)+CO(g)△H=+131.3kJmol﹣1 ,
②CO(g)+H2O(g) ![]() CO2(g)+H2(g).
CO2(g)+H2(g).
(1)下列说法正确的是 .
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为 .
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 | ||
CO | H2O | H2 | CO2 | |||
I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
Ⅲ | 900 | a | b | c | d | t |
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为 .
②CO(g)和H2O(g)反应的△H0 ( 填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是 , 与实验Ⅱ相比,化学平衡常数(填“增大”、“减小”或“不变”).
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2 , 平衡向方向移动(填“正反应”、“逆反应”“不移动”).
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0): 反应①:CO(g)+2H2(g)CH3OH(g)△H=﹣mkJmol﹣1
反应②:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H=﹣nkJmol﹣1
反应③:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为 .
【答案】
(1)A
(2)粉碎煤炭、增加H2O的浓度、使用合适的催化剂
(3)0.04mol/(L?min);小于;a<b;不变;正反应
(4)n>2m
【解析】解:(1)A.因为反应①可知反应物C为固体,所以反应前后质量在变,又体积固定,所以当反应①的密度是变化值,当密度不再变化时反应达到最大限度,故A正确; B.反应物和生成物都是气体,且化学计量总数相等,故该反应的△S无法判断,故B错误;
C.碳为固体,增加其量不会影响反应速率,故C错误;
D.在反应中②及时分离出产生的H2相当于减小了反应物的浓度,逆反应速率瞬时减小,正反应速率会逐渐减小,故D错误;
故选:A;(2)根据反应①的特点,增加反应速率最经济的方法有:一是将C固体粉碎,增加反应接触面积从而增加反应速率,二是增加水蒸气的浓度来增加反应速率,三是采用合适的催化剂来提高反应速率,所以答案是:粉碎煤炭、增加H2O的浓度、使用合适的催化剂;(3)①根据方程式可知v(H2O)=v(CO2),则v(H2O)=v(CO2)= ![]() =0.04mol/(Lmin),所以答案是:0.04mol/(Lmin);
=0.04mol/(Lmin),所以答案是:0.04mol/(Lmin);
②实验I达平衡时,
H2O(g)+ | CO(g) | CO2(g)+ | H2(g) | |
初始 | 1mol/L | 2mol/L | 0 | 0 |
转化 | 0.8mol/L | 0.8mol/L | 0.8mol/L | 0.8mol/L |
平衡 | 0.2mol/L | 1.2mol/L | 0.8mol/L | 0.8mol/L |
根据K= ![]() 计算可得该反应在650℃时平衡常数数值为K=
计算可得该反应在650℃时平衡常数数值为K= ![]() =2.67,
=2.67,
实验Ⅱ达平衡时,
H2O(g)+ | CO(g) | CO2(g)+ | H2(g) | |
初始 | 1mol/L | 0.5mol/L | 0 | 0 |
转化 | 0.25mol/L | 0.25mol/L | 0.25mol/L | 0.25mol/L |
平衡 | 0.75mol/L | 0.25mol/L | 0.25mol/L | 0.25mol/L |
根据K= ![]() 计算可得该反应在900℃时平衡常数数值为K=
计算可得该反应在900℃时平衡常数数值为K= ![]() =
= ![]() ,可见温度升高K减小,反应为放热反应,△H<0
,可见温度升高K减小,反应为放热反应,△H<0
所以答案是:小于;
③CO(g)+H2O(g) ![]() CO2(g)+H2(g)反应中,CO和H2O的计量数相同,当CO和水蒸气的物质的量相等时二者转化率相等,故当水蒸气的物质的量大于CO时,CO的转化率大于水蒸气,则a<b;又平衡常数仅与温度有关,所以实验III中与实验Ⅱ相比,化学平衡常数不变;
CO2(g)+H2(g)反应中,CO和H2O的计量数相同,当CO和水蒸气的物质的量相等时二者转化率相等,故当水蒸气的物质的量大于CO时,CO的转化率大于水蒸气,则a<b;又平衡常数仅与温度有关,所以实验III中与实验Ⅱ相比,化学平衡常数不变;
所以答案是:a<b;不变;
④在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2 , 此时有2.5molCO、1mol H2O、0.7mol CO2、1mol H2 , 则c(CO)=1.25molL﹣1 , c(H2O)=0.5molL﹣1 , c(CO2)=0.35molL﹣1 , c(H2)=0.5molL﹣1 , 此时Q= ![]() =0.28<K,故反应应向正反应方向进行,所以答案是:正反应;(4)①:CO(g)+2H2(g)CH3OH(g)△H=﹣mkJmol﹣1
=0.28<K,故反应应向正反应方向进行,所以答案是:正反应;(4)①:CO(g)+2H2(g)CH3OH(g)△H=﹣mkJmol﹣1
②:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H=﹣nkJmol﹣1
③:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0
根据盖斯定律,②﹣①×2可得③:2CH3OH(g)CH3OCH3(g)+H2O(g)△H=(2m﹣n)<0,所以n>2m,所以答案是:n>2m.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).


科目:高中化学 来源: 题型:
【题目】如图是MgSO4、NaCl的溶解度曲线.下列说法正确的是( ) 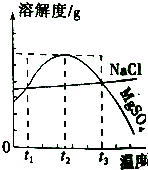
A.MgSO4的溶解度随温度升高而升高
B.NaCl的溶解度比MgSO4的溶解度大
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室收集NO、NO2两种气体,下列收集方法正确的是( )
A. 均可用排水法B. 均可用向上排空气法
C. NO用向上排空气法,NO2用排水法D. NO用排水法,NO2用向上排空气法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中正确的是( )
A.米酒变酸的过程涉及了氧化反应
B.汽油、柴油、植物油都是碳氢化合物
C.3.0 g 甲醛和乙酸的混合物中含有的原子总数为0.6NA
D.0.1 mol C2H6O分子中含有C﹣H键数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度溶液时,会导致所配溶液浓度偏大的操作是( )
A.在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中
B.用量筒量取浓硫酸时,俯视刻度线
C.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理
D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的最高正价和最低负价的绝对值之差为6,Y元素的离子与X元素的离子具有相同的电子层结构,则X、Y形成的化合物可能是
A. MgF2B. K2SC. NaClD. KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com