
将足量的SO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3-
B.H+、NH4+、Al3+、SO42-
C.Na+、Cl-、MnO4-、SO42-
D.Na+、CO32-、CH3COO-、HCO3-
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
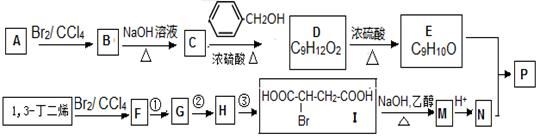
(1)B的名称为_____________,E中所含官能团的名称为 ;
(2)I由F经①~③合成,F可以使溴水褪色。
a.①的化学方程式是
b.②的反应试剂是
c.③的反应类型是
(3)下列说法正确的是
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol最多消耗3molNaOH
d.N不存在顺反异构体
(4)写出E与N按照物质的量之比为1:1发生共聚生成P的化学反应方程式 高聚物P的亲水性比由E形成的聚合物_____(填“强、弱”)。
(5)D的同系物K比D分子少一个碳原子,K 有多种同分异构体,符合下列条件的K的同分异构体有 种。写出其中核磁共振氢谱为1:2:2:2:3的一种同分异构体的结构简式 。
a.苯环上有两种等效氢
b.能与氢氧化钠溶液反应
c.一定条件下1mol该有机物与足量金属钠充分反应,生成1molH2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:选择题
溶液X中可能含有K+、Mg2+、Al3+、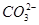 、
、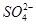 、
、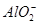 、
、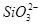 、
、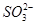
中的若干种离子。某同学对该溶液进行了如下实验:
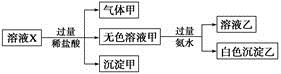
下列判断正确的是
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、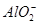 和
和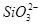 一定存在于溶液X中
一定存在于溶液X中
D.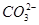 和
和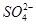 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式正误判断(解析版) 题型:选择题
下列离子方程式正确的是
A.钠与水反应:Na+2H2O=Na+ +2OH- + H2↑
B.硅酸钠溶液与醋酸溶液混合:SiO3 2-+2H+=H2SiO3↓
C.0.01mol/L NH4Al(SO4)2 溶液与0.02mol/L Ba(OH)2 溶液等体积混合:NH4+ +Al3++2SO42- +2Ba2+ +4OH- =2 Ba SO4 ↓+Al(OH)3 ↓+ NH3·H2O
D.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ Fe3+ +3NO2+3H2O
Fe3+ +3NO2+3H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32-
B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3-
D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是
A.水溶液中:K+、Ca2+、Cl-、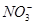
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、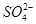 、葡萄糖分子
、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+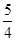 O2(g)===
O2(g)===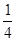 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
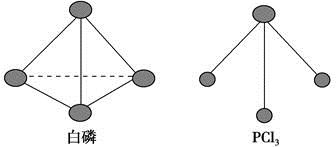
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解三池的应用(解析版) 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是_________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:___________________________。
(5)ZX的电子式为___________;ZX与水反应放出气体的化学方程式为____。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
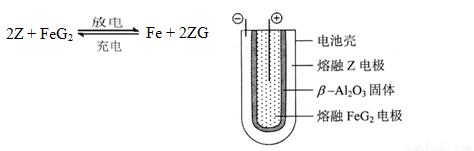
放电时,电池的正极反应式为_______________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com