
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素。Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z最外层电子数之和与W的最外层电子数相同,25℃0.01mol·L-1 X和W形成化合物的水溶液pH为2,下列说法正确的是
A. Y元素的非金属性大于W元素
B. X和Y可以形成既含极性键又含非极性键的分子
C. YZ和YZ2均可以被NaOH溶液直接吸收
D. X和W形成的化合物中各原子均为8电子稳定结构
【答案】B
【解析】
X、Y、Z、W是原子序数依次增大的四种短周期元素,25℃时0.01mol/LX和W形成化合物的水溶液pH为2,则二者形成的化合物是一元强酸,则X是H元素、W是Cl元素;Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z的原子最外层电子数之和等于W的原子最外层电子数,则Z最外层电子数是6,Z为O元素,Y为C元素,据此分析解题。
X、Y、Z、W是原子序数依次增大的四种短周期元素,25℃时0.01mol/LX和W形成化合物的水溶液pH为2,则二者形成的化合物是一元强酸,则X是H元素、W是Cl元素;Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z的原子最外层电子数之和等于W的原子最外层电子数,则Z最外层电子数是6,Z为O元素,Y为C元素;
A.Y是C、W是Cl元素,Cl元素的非金属性比C元素强,故A错误;
B.X为H、Y为C,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,X和Y能形成既含极性键又含非极性键的分子,如含有多个碳原子的烃,故B正确;
C.Y是C、Z是O元素,CO2能被NaOH溶液吸收,而CO不与NaOH溶液反应,故C错误;
D.X是H、W是Cl元素,两者形成的化合物HCl的电子式为![]() ,可知H元素形成的是2个电子的稳定结构,故D错误;
,可知H元素形成的是2个电子的稳定结构,故D错误;
故答案为B。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】现有四种短周期元素A,B,C,D,已知:①C,D在同一周期,A,B在同一主族;②它们可以组成化合物A2C、B2C2、DC2、D2A4等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应生成气体A2,A2与气体C2按体积比2∶1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体。请回答:
(1)写出元素符号:A________、B________、C________、D________。
(2)在A2C、B2C2、DC2和D2A4中,同时含有离子键和非极性共价键的化合物的电子式为__________;按原子轨道重叠方式,其非极性键的类型是________。化合物DC2的结构式__________。
(3)A2C分子的电子式____________,按原子轨道重叠方式,其共价键的类型是____________。D2A4是平面形分子,其分子中含有______个σ键,______个π键。
(4)写出化学方程式或离子方程式:
B2C2与A2C反应的化学方程式:___________________________________________;
B2C2与DC2反应的化学方程式:___________________________________________;
B与A2C反应的离子方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机酸有机酯在生产中具有广泛的应用,回答下列问题:
(1)硫酸氢乙酯( )可看作是硫酸与乙醇形成的单酯,工业上常通乙烯与浓硫酸反应制得,该反应的化学方程式为_________,反应类型为__________,写出硫酸与乙醇形成的双酯—硫酸二乙酯(
)可看作是硫酸与乙醇形成的单酯,工业上常通乙烯与浓硫酸反应制得,该反应的化学方程式为_________,反应类型为__________,写出硫酸与乙醇形成的双酯—硫酸二乙酯(![]() )的结构简式_____。
)的结构简式_____。
(2)磷酸三丁酯常作为稀土元素富集时的萃取剂,工业上常用正丁醇与三氯氧磷(![]() )反应来制备,该反应的化学方程式为__________,反应类型为________。写出正丁醇的任意一个醇类同分异构体的结构简式___________。
)反应来制备,该反应的化学方程式为__________,反应类型为________。写出正丁醇的任意一个醇类同分异构体的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18-Ⅰ分子中只有两种不同化学环境的氢,且数目比为3:2的化合物(________)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
Ⅱ奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
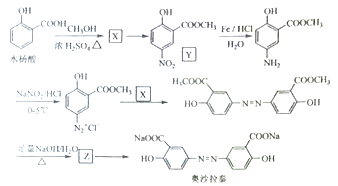
回答下列问题:
(1)X的结构简式为____;由水杨酸制备X的反应类型为_____。
(2)由X制备Y的反应试剂为_________。
(3)工业上常采用廉价的![]() ,与Z反应制备奥沙拉秦,通入的
,与Z反应制备奥沙拉秦,通入的![]() 与Z的物质的量之比至少应为____。
与Z的物质的量之比至少应为____。
(4)奥沙拉秦的分子式为______,其核磁共振氢谱为______组峰,峰面积比为______。
(5)若将奥沙拉秦用![]() 酸化后,分子中含氧官能团的名称为____。
酸化后,分子中含氧官能团的名称为____。
(6)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是

A. N极的电极反应式为2HSO3-+2H++e-==S2O42-+2H2O
B. M极的电极反应式为SO2+2H2O-2e-==SO42-+4H+
C. 离子交换膜为阴离子交换膜
D. b为直流电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是

A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g) =2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g) =2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g) =3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__________。
(2)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。

①电源正极为____(填“A”或“B”),阴极的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为____________。
(2)X与M组成的物质为_____________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为__________。
(3)Y在周期表中的位置是____________,其含氧酸的化学式为______________。
(4)L与M形成的化合物中L的化合价是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com