
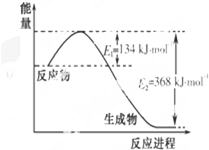
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.15 |
| 0.3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
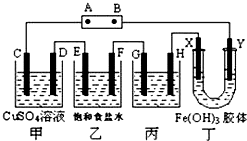 课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室配制480mL 0.1mol?L-1的Na2CO3溶液,回答下列问题:
实验室配制480mL 0.1mol?L-1的Na2CO3溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2CO3、H2SiO3、HCl都属于弱酸 |
| B、Na2O、MgO、Al2O3都属于碱性氧化物 |
| C、石英、纯碱、明矾都属于盐 |
| D、水玻璃、铁红、水泥都属于混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com