
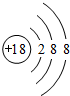
| ① | ⑩ | ② | ③ | ||||||||||||||
| ④ | ⑤ | ⑦ | ⑧ | ⑨ | |||||||||||||
| ⑥ | |||||||||||||||||
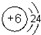
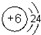






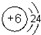 ,最高价氧化物二氧化碳是含有碳氧双键的非极性分子,
,最高价氧化物二氧化碳是含有碳氧双键的非极性分子, ,氯化镁是镁离子和氯离子之间通过离子键形成的离子化合物,用电子式表示其的形成过程为:
,氯化镁是镁离子和氯离子之间通过离子键形成的离子化合物,用电子式表示其的形成过程为: ,
,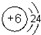 ;
; ;
; ;
; ,电极反应为:Al-3e-=Al3+,
,电极反应为:Al-3e-=Al3+, ;Al-3e-=Al3+;
;Al-3e-=Al3+;

科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |



| 实验步骤 | 实验现象 |
| 1.将一小块④的单质放入滴有酚酞溶液的冷水中 | 钠浮在水面上,熔成小球,四处游动 钠浮在水面上,熔成小球,四处游动 ,发出嘶嘶响声,逐渐消失,溶液变成红色 |
| 2.将少量冷水注入盛有打磨过的⑤的单质的试管中,再滴加酚酞,一段时间后加热至沸腾 | 加热后 镁条表面产生无色气泡,溶液呈红色 镁条表面产生无色气泡,溶液呈红色 |
| 3.将2mL 1mol/L盐酸加入盛有打磨过的⑤的单质的试管中 | 剧烈反应,迅速产生大量无色气泡 |
| 4.将2mL 1mol/L盐酸加入盛有打磨过的 Al Al 的单质的试管中 |
反应缓慢,一段时间后,产生无色气泡 |
| 结论: Na、Mg、Al三种元素的金属性依次减弱 Na、Mg、Al三种元素的金属性依次减弱 (用元素符号结合文字说明) | |
查看答案和解析>>
科目:高中化学 来源: 题型:
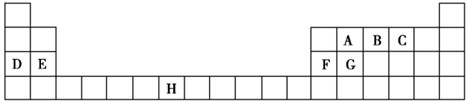
| A | |||||||||||||||||
| B | C | D | |||||||||||||||
| E | F | G | |||||||||||||||
| H | |||||||||||||||||


查看答案和解析>>
科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
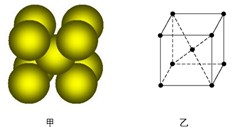
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com