
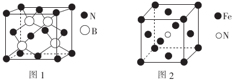
 (标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.
(标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.分析 (1)基态15N中核外有7个电子,砷元素位于第四周期且和氮元素同主族,为33号元素,根据核外电子排布规律书写电子排布式;
(2)同周期元素从左向右,第一电离能逐渐增大,但第ⅡA和ⅤA元素由于最外层是充满或半满状态,是一种稳定结构,第一电离能高于同周期相邻元素,根据NF3分子中氮原子的价层电子对数及孤电子对数判断分子的空间构型;
(3)氨基乙酸(H2N-CH2-COOH)中,中的碳原子周围有四个σ键,羧基中的碳原子周围有三个σ键,没有孤电子对,据此判断;1molH2N-CH2-COOH中含有9个共价键,据此判断σ键的数目,二氧化碳中有三个碳原子,价电子数为16,据此书写等电子体;
(4)根据晶体的熔沸点可判断晶体类型,硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,BF3能与NH3反应生成BF3•NH3,N原子含有孤电子对;根据图1,利用均摊法可确定化学式;
(5)铁和氨气在640℃可发生置换反应生成氢气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式;
由$ρ=\frac{m}{V}$计算晶胞的密度.
解答 解:(1)基态15N中核外有7个电子,所以有7个运动状态不相同的电子,砷元素位于第四周期且和氮元素同主族,为33号元素,其外电子排布式为1s22s22p63s23p63d104s24p3 ,
故答案为:7;1s22s22p63s23p63d104s24p3;
(2)同周期元素从左向右,第一电离能逐渐增大,但第ⅡA和ⅤA元素由于最外层是充满或半满状态,是一种稳定结构,第一电离能高于同周期相邻元素,所以C、N、O的第一电离能由大到小排列的顺序为N>O>C,NF3分子中氮原子的价层电子对数为$\frac{5+3}{2}$=4,有一对孤电子对,所以分子的空间构型为三角锥形,
故答案为:N>O>C;三角锥形;
(3)氨基乙酸(H2N-CH2-COOH)中,CH2中的碳原子周围有四个σ键,杂化类型为sp3杂化,羧基中的碳原子周围有三个σ键,没有孤电子对,杂化类型为sp2杂化,1molH2N-CH2-COOH中含有9个共价键,所以σ键的数目9NA,二氧化碳中有三个原子,价电子数为16,与之互为等电子体的为N20、N3-等,
故答案为:sp3、sp2;9NA;N20、N3-等;
(4)三氯化硼和三氟化硼常温下都是气体,所以它们固态时的晶体类型为分子晶体,硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,BF3能与NH3反应生成BF3•NH3,B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对,BF3•NH3结构式为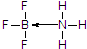 ,根据图1,利用均摊法可知,晶胞中含有B原子数为4,晶胞中含有N原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,所以化学式为BN,
,根据图1,利用均摊法可知,晶胞中含有B原子数为4,晶胞中含有N原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,所以化学式为BN,
故答案为: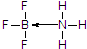 ;BN;
;BN;
(5)该晶胞中铁原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氢气和氮化铁,所以该反应方程式为8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2,该晶胞的边长为anm,则晶胞的体积为(a×10-7)3cm3,所以密度为$\frac{\frac{238}{{N}_{A}}}{({a×10{\;}^{-7})}^{3}}$g?cm-3=$\frac{2.38×1{0}^{23}}{{a}^{3}{N}_{A}}$g?cm-3,
故答案为:8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2;$\frac{2.38×1{0}^{23}}{{a}^{3}{N}_{A}}$.
点评 本题考查了有关硼的知识,侧重考查原子核外电子排布、第一电离能、杂化理论的应用、晶胞的计算等知识点,题目难度中等,注意物质结构基础知识的灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 、
、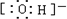 、
、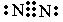 、
、 、
、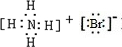 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再加点溶质到容量瓶中去 | B. | 影响不大,不再处理 | ||
| C. | 重新配制 | D. | 以上措施都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
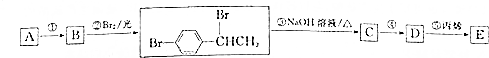
 或
或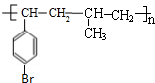 .
.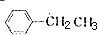 +Br2$\stackrel{铁}{→}$
+Br2$\stackrel{铁}{→}$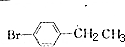 +HBr.反应③的化学方程式
+HBr.反应③的化学方程式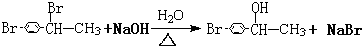 .
.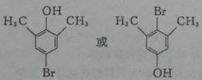 (任写一种).
(任写一种).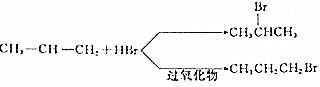
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.
太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
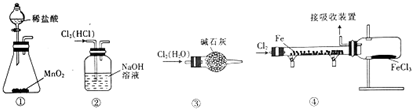
| A. | 用装置①制取氯气 | B. | 用装置②除去Cl2中的HCl | ||
| C. | 用装置③干燥氯气 | D. | 用装置④制取并收集FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
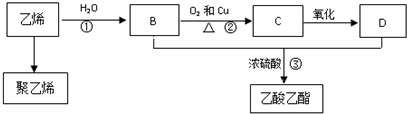
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由D和18O所组成的水11g,所含中子数为4NA | |
| B. | 1 L 0.4 mol•L-1稀硝酸与Fe完全反应,转移电子数为0.3NA | |
| C. | 标准状况下,2.24LCHCl3所含分子数为0.1NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都能发生水解 | |
| B. | Na2CO3、NaHCO3可用作食用碱或工业用碱 | |
| C. | “地沟油”禁止食用,但可以用来制肥皂或生产燃料油 | |
| D. | 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com