
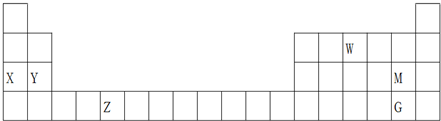
| A. | 最高价氧化物的水化物的碱性:X<Y | |
| B. | W的氢化物的球棍模型为: | |
| C. | 酸性:HMO4<HGO4 | |
| D. | Z的某些化合物可以用作反应的催化剂 |
分析 由元素在周期表的位置可知,X为Na,Y为Mg,Z为V,W为N,M为Cl,G为Br,
A.金属性越强,最高价氧化物的水化物的碱性越强;
B.氨气为三角锥型;
C.非金属性越强,最高价氧化物的水化物的酸性越强;
D.V的化合物可作合成氨的催化剂.
解答 解:由元素在周期表的位置可知,X为Na,Y为Mg,Z为V,W为N,M为Cl,G为Br,
A.金属性X>Y,最高价氧化物的水化物的碱性为X>Y,故A错误;
B.氨气为三角锥型, 为比例模型,故B错误;
为比例模型,故B错误;
C.非金属性M>G,最高价氧化物的水化物的酸性为HMO4>HGO4,故C错误;
D.V的化合物可作合成氨的催化剂,则Z的某些化合物可以用作反应的催化剂,故D正确;
故选D.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、物质的性质与结构、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | D、E两种元素仅可组成化学式为E2D的化合物 | |
| B. | 原子半径:E>F>C>D | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性:D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01 mol/(L•s) | B. | v(NO)=0.08 mol/(L•s) | ||
| C. | v(H2O)=0.003 mol/(L•s) | D. | v(NH3)=0.001 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$ SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 充电时锌极与外电源正极相连 | |
| C. | 放电时每转移3 mol电子,正极有1mol K2FeO4被还原 | |
| D. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 醋酸纤维、硝化纤维、合成纤维、光导纤维都可由纤维素在一定条件下制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁金属活泼性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | ①④⑤ | B. | ②③⑤ | C. | ①②③④⑤⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com