
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。
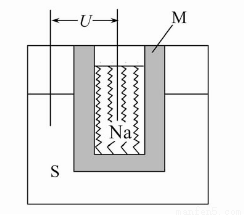
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 __ 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”、“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
(1)2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ CS2(或热的NaOH溶液)
2CH3CH2ONa+H2↑ CS2(或热的NaOH溶液)
(2)xS+2e-=Sx2- (或2Na++xS+2e-=Na2Sx) 导电和隔离钠与硫 4.5
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) 减小 2S2-+O2+2H2O=4OH-+2S↓
【解析】(2)正极的电极反应式为:xS+2e-= Sx2-,M的作用:一是导电,二是因钠与硫易反应,故它起到隔离作用;钠高能电池中负极为钠,有23 g钠消耗释放1 mol e-,则207 g钠消耗时转移207/23 mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池中铅是负极,207 g铅消耗时转移2 mol e-,故钠硫电池的理论放电量是铅蓄电池的(207/23)∶2=4.5倍。
(3)根据电离与水解的知识可判断:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),加入少量固体CuSO4后,溶液中发生离子反应:Cu2++S2-=CuS↓,由于c(S2-)降低,故由S2-水解产生的OH-量减小,c(OH-)变小,c(H+)变大,溶液的pH减小;Na2S溶液长期放置所发生的化学反应方程式为2Na2S+O2+2H2O=4NaOH+2S↓,故离子方程式为2S2-+O2+2H2O=4OH-+2S↓。


科目:高中化学 来源:2014年化学高考题型专练三 特定条件下离子方程式的书写与判断练习卷(解析版) 题型:选择题
下列所述事实与化学(或离子)方程式不相符的是 ( )。
A.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O
B.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O
C.能说明盐酸是强酸:2HCl+CaCO3=CaCl2+CO2↑+H2O
D.能说明CH3COOH是弱电解质:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:选择题
某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大
B.K随着温度的升高而增大
C.K越小,达到平衡时,反应物的转化率越大
D.K随反应物浓度的改变而改变
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:填空题
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:

已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:选择题
在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3,铜粉可溶解的是( )
A.①② B.②④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 9-1原电池 化学电源练习卷(解析版) 题型:选择题
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
A.用氧化剂使金属表面生成致密稳定的氧化物保护膜
B.在金属中加入一些铬或镍制成合金
C.在轮船的壳体水线以下部分装上锌锭
D.金属表面喷漆
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(解析版) 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:

(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
Fe+2Fe3+=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→ ③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+  Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用_______方法。

查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-3盐类的水解练习卷(解析版) 题型:选择题
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-2化学平衡状态化学平衡移动练习卷(解析版) 题型:选择题
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g) 2C(g) ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
2C(g) ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com