



科目:高中化学 来源: 题型:
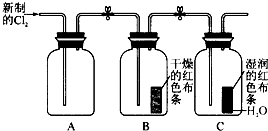 某学习小组设计了如图所示的实验方案来探究氯气的性质.
某学习小组设计了如图所示的实验方案来探究氯气的性质.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面 少 少 |
较上面 多 多 |
较上面 多 多 |
慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
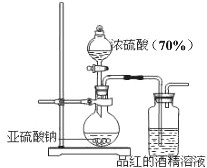 为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.
为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.| c(SO32-) | c(HSO3-) | c(H2SO3) | 褪色速度 | |
| Na2SO3溶液 | 大 | 小 | 小 | 快 |
| NaHSO3溶液 | 较上面 |
较上面 |
较上面 |
慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面______ | 较上面______ | 较上面______ | 慢 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com