
| A. | 在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中 | |
| D. | 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 |
分析 A.依据腐蚀品称量方法解答;
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出,吸出的溶液中含有溶质,导致溶液浓度偏低;
C.为保证溶质全部转移到容量瓶中,应进行洗涤操作;
D.定容时俯视容量瓶的刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析.
解答 解:A.氢氧化钠为腐蚀品,称量应放在小烧杯或者称量瓶中进行,故A错误;
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出,导致溶质损耗,依据c=$\frac{n}{V}$可知溶液浓度偏低,故B 错误;
C.用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中,保证溶质全部转移到容量瓶中,故C正确;
D.定容时俯视容量瓶的刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$,可知溶液浓度偏高,故D错误;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意对腐蚀品称量方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
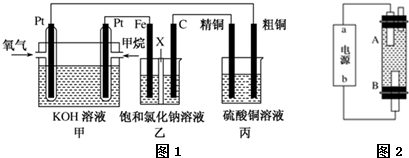
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,促进CO32-水解,pH减小 | |
| B. | 离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 离子浓度:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C被氧化 | D. | 亚硝酸盐发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +Br2
+Br2
 +HO-NO2
+HO-NO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
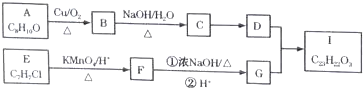
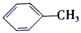 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$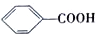
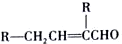
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
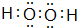 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com