
| A. | 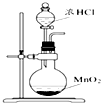 可用装置甲制取氯气 | |
| B. | 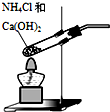 可用装置乙制取氨气 | |
| C. | 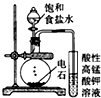 可用装置丙制取并检验乙炔(乙炔中含有H2S、PH3) | |
| D. | 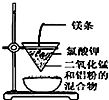 可用装置丁制得金属锰 |
分析 A.浓盐酸与二氧化硫反应需要加热;
B.制备氨气时反应生成水,试管口不能向上;
C.乙炔、H2S等均能被高锰酸钾氧化;
D.点燃镁条,引发铝热反应,Al与二氧化锰发生氧化还原反应.
解答 解:A.浓盐酸与二氧化硫反应需要加热,图中缺少酒精灯加热,故A错误;
B.制备氨气时反应生成水,试管口不能向上,图中试管口应略向下倾斜,故B错误;
C.乙炔、H2S等均能被高锰酸钾氧化,应先利用硫酸铜溶液除杂,再利用高锰酸钾溶液检验乙炔,故C错误;
D.点燃镁条,引发铝热反应,Al与二氧化锰发生氧化还原反应可制得金属锰,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、实验装置的作用、基本技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、糖类、蛋白质均能在一定条件下发生水解反应 | |
| B. | 乙烯能使溴水、高锰酸钾酸性溶液褪色,且褪色原理相同 | |
| C. | 棉、麻、羊毛、蚕丝均属于天然高分子材料 | |
| D. | 石油的分馏与煤的干馏主要是通过物理变化得到成分不同的有机物 |
查看答案和解析>>
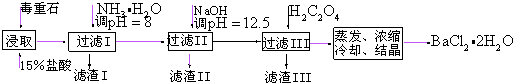
科目:高中化学 来源: 题型:推断题
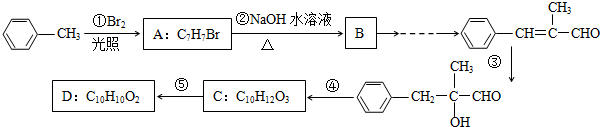

 .
. ,无机试剂任选,格式参照图.
,无机试剂任选,格式参照图. .
.查看答案和解析>>
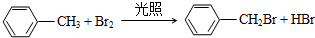
科目:高中化学 来源: 题型:推断题
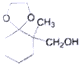 ;
; )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(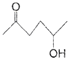 )的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
)的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH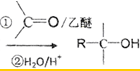
查看答案和解析>>
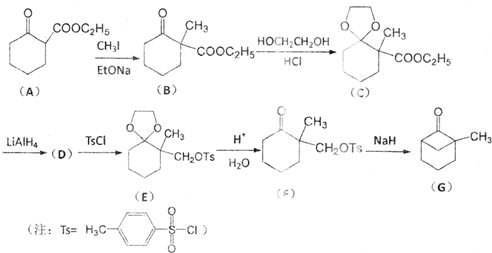
科目:高中化学 来源: 题型:推断题
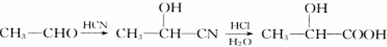

 .
.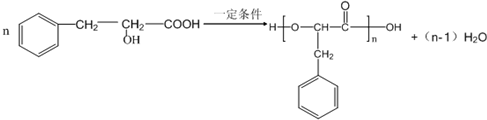 .
.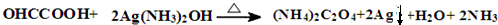 .
.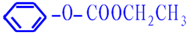
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于1.2 mol | B. | 1.2 mol | C. | 大于1.6 mol | D. | 1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- | B. | CO32- | C. | NO3- | D. | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
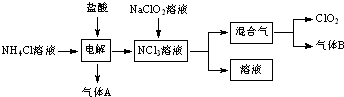
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com