
分析 (1)根据操作步骤选取实验仪器,判断缺少的仪器;
(2)①不能用量筒配制溶液;
②不能将水加入到浓硫酸中.
解答 解:(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故需要的仪器有:烧杯、筒量、玻璃棒、100mL容量瓶、胶头滴管,
故实验所用的玻璃仪器除烧杯、胶头滴管、容量瓶外,还有:玻璃棒、量筒,
故答案为:玻璃棒、量筒;
(2)不能用量筒配制溶液,不能将水加入到浓硫酸中,故该做法不正确,
故答案为:①不能用量筒配制溶液;②不能将水加入到浓硫酸中.
点评 考查一定物质的量浓度溶液的配制,难度不大,注意浓硫酸的稀释,根据c=$\frac{n}{V}$理解溶液配制原理.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2=2HCO3-+Cl-+ClO- | |
| C. | 向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5 | |
| D. | 向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ•mo-l,逆反应的活化能为Eb kJ•mol-l,则△H=-( Ea-Eb)kJ.mol-l | |
| B. | 某温度下,氯化钠在水中的溶解度是20 g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% | |
| C. | 将0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
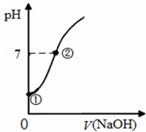 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在次氯酸的电离平衡 | |
| B. | ②点所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “沙尘暴”属于一种自然现象,与人类活动无关 | |
| B. | 碳酸铝是一种应用很广的视频添加剂,可大量添加到馒头、面包、油条等食品中 | |
| C. | 利用垃圾发电能达到节能减排的目的 | |
| D. | 持续高温天气的出现与人类活动无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③④ | C. | ①③④⑤ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 加水稀释后,n(H+)与n(OH-)的乘积变大 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com