
现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为( )
A.1.0g B.2.0g C.2.5g D.3.5g
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
0.2 mol纯钠在只含氧气和氯气的密闭容器中燃烧,反应后冷却至常温,容器内固体 的质量不可能为 (
的质量不可能为 (  )。
)。
A.4.8 g B.6.2 g
C.7.8 g  D.11.7 g
D.11.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)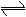
 PCl5(g);5min末达到平衡,有关数据如下表。
PCl5(g);5min末达到平衡,有关数据如下表。
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | C1 | C2 | 0.4 |
下列判断不正确的是
当反应达到平衡状态,容器中Cl2为1.2mol
反应5min内,V(PCl3)=0.08mol/(L·min)
达到平衡后再向容器中充入少量PCl5(g),混合气体的平均摩尔质量将变小。
平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达到平衡时,C(PCl5)<0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
20℃时,11.6g由CO2和H2O组成的混合气体与足量的Na2O2充分反应,固体质量增加3.6g,则原混合气体的平均摩尔质量为(g/mol) ( )
A.5.8 B. 11.6 C. 23.2 D. 46.4
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量Fe和Fe2O3的混合物投入250mL 2mol/L的硝酸溶液中,反应完成后,无固体剩余,生成1.12L NO(标准状况),再向反应后的溶液中加入1mol/L NaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液的体积最少是( )
A、400mL B、450mL C、500 mL D、无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组取一定质量的FeSO4固体,利用下图装置进行实验。250mL容量瓶
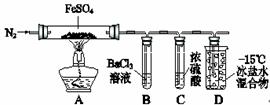
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点–72℃,沸点–10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是 。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是 。
(3)实验④反应的离子方程式是__ _____。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,原因是(用必要的文字和化学方程式解释)___ __ (填“正确”或“不正确”)理由
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生反应:2A(g)+2B(g)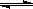 xC(g)+2D(g),在2L密闭容器中,把4molA和
xC(g)+2D(g),在2L密闭容器中,把4molA和
2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率V(D)=0.2mol·L-1·min-1,
下列说法正确的是
A.A和B的转化率均是20% B.x = 4
C.平衡时A的物质的量为2.8mol D.平衡时气体压强比原减小
查看答案和解析>>
科目:高中化学 来源: 题型:
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l) ΔH<0
一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因
素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
 (1)该实验探究的是 ▲ 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: ▲ < ▲ (填实验序号)
(1)该实验探究的是 ▲ 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: ▲ < ▲ (填实验序号)
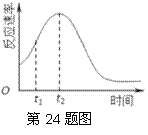
(2)研究发现反应速率总是如右图所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,
② ▲ 。
(3) 若实验①在4 min末收集了4.48 mL CO2(标准状况),则4 min末c(MnO4-)= ▲ mol·L-1(假设溶液混合后体积为50 mL),此4 min内的平均速率为v(H2C2O4)= ▲ 。
(4)除通过测定一定时间内CO2的体积比较反应速率,本实验还可以通过测定
▲ 比较化学反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是Zn和Cu(稀硫酸)形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )
| ① Cu为负极,Zn为正极 ② H+向负极移动 ③ 电子的流动方向是:Zn→Cu ④ Cu极上有H2产生 ⑤ 若有1mol电子流经导线,则可产生0.5mol H2气体 ⑥ 正极反应式:Zn-2e-===Zn2+ |
A.①②③ B.③④⑤
C.④⑤⑥ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com