
分析 由步骤可知,碳酸钠水解显碱性,可促进油污的水解,加稀硫酸除去碳酸钠,且溶解Fe,过滤后,滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,经过过滤,洗涤,干燥,灼烧得到氧化铁;
(1)根据反应已经充分时反应停止即无现象发生判断;
(2)①Fe3C在足量的空气中高温煅烧,生成有磁性的固体X,X为Fe3O4,所以该反应方程式为:Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2,据此计算;
②X为Fe3O4,将X溶于稀硫酸反应生成硫酸亚铁、硫酸铁,据此书写离子方程式;
(3)步骤2滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,据此书写离子方程式;
(4)将步骤4经过过滤,洗涤,干燥,得到FeCO3固体;
(5)①根据以上分析煅烧后肯定生成氧化铁,要检验产品中是否存在FeO,则应先用酸将其溶解,再用酸性KMnO4溶液检验含有三价铁离子时是否含有二价铁离子;
②假设Fe2O3物质的量为x mol,FeO的物质的量为y mol,根据质量守恒和铁原子守恒列方程组计算.
解答 解:(1)因为反应已经充分时反应停止即无现象发生,所以当溶液中不再产生气泡时可以判断反应已经充分,
故答案为:溶液中不再产生气泡;
(2)①Fe3C在足量的空气中高温煅烧,生成有磁性的固体X,X为Fe3O4,所以该反应方程式为:Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2,则煅烧时1mol W(Fe3C),消耗O2 3mol,
故答案为:3;
②X为Fe3O4,将X溶于稀硫酸反应生成硫酸亚铁、硫酸铁,则离子方程式为 Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)步骤2滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,则生成FeCO3沉淀的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,故答案为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;
(4)将步骤4经过过滤,洗涤,干燥,得到FeCO3固体,故答案为:过滤;洗涤;
(5)①根据以上分析煅烧后肯定生成氧化铁,要检验产品中是否存在FeO,则应先用酸将其溶解,再用酸性KMnO4溶液检验含有三价铁离子时是否含有二价铁离子,又酸性KMnO4溶液会氧化氯离子,所以应选用硫酸溶解,所以这两种试剂是稀硫酸和酸性KMnO4溶液,
故答案为:稀硫酸和酸性KMnO4溶液;
②假设Fe2O3物质的量为x mol,FeO的物质的量为y mol,那么满足:160x+72y=79200;铁原子守恒(2x+y)×116=116000,解得x=450mol,所以产物中Fe2O3的质量160g/mol×450mol=72000g=72kg,则该产品的纯度为$\frac{72g}{79.2g}$×100%=90.9%;故答案为:90.9%.
点评 本题考查元素化合物性质、基本操作与方案设计、常用化学用语等,关键是熟练综合应用相关元素化合物知识,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:实验题
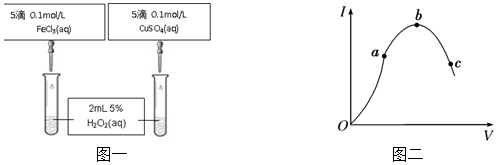
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
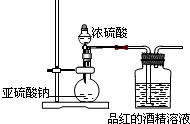
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
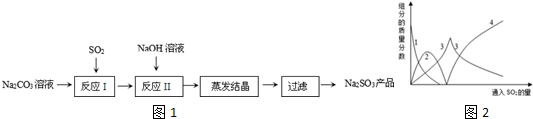
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
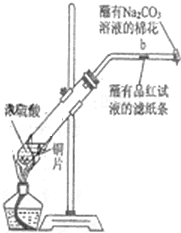 如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:
如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
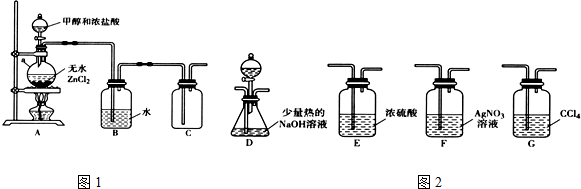
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
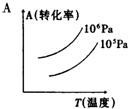 有一化学平衡mA(g)+nB(g)═PC(g)+qD(g),如图表示的转化率与压强、温度的关系.由此得出的正确结论是( )
有一化学平衡mA(g)+nB(g)═PC(g)+qD(g),如图表示的转化率与压强、温度的关系.由此得出的正确结论是( )| A. | 正反应是吸热反应,(m+n)>(p+q) | B. | 正反应是吸热反应,(m+n)<(p+q) | ||
| C. | 正反应是放热反应,(m+n)>(p+q) | D. | 正反应是放热反应,(m+n)<(p+q) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag | |
| D. | 硫酸溶液与氢氧化铜反应:H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com