
【题目】欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时体积变化)。
科目:高中化学 来源: 题型:
【题目】下列有关糖类、脂肪和蛋白质的叙述正确的是( )
A.糖类都能表示为Cm(H2O)n
B.糖类和脂肪都是储能物质
C.脂肪由脂肪酸和甘油构成,所以脂肪是一种高分子化合物
D.糖类、脂肪和蛋白质都能氧化分解释放能量供给生物利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中
(1)互为同分异构体的是________,
(2)互为同素异形体的是________,
(3)互为同位素的是________,
(4)属于同一物质的是________。
①C(CH3)4和C4H10
②![]() 和
和![]()
③35Cl和37Cl
④![]() H2O和
H2O和![]() H2O
H2O
⑤石墨和金刚石
⑥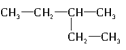 和
和![]()
⑦(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH3
⑧H2 D2 T2
⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
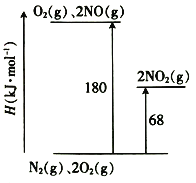
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 mol NO2的能量变化)。1 mol NO氧化为NO2的焓变△H=___________。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g) ![]() N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) ![]() N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是__________(填“a”或“b”);反应2NO(g)+O2(g) ![]() 2NO2(g)的K=_____________。
2NO2(g)的K=_____________。
(3)已知反应2NO(g)+O2(g) ![]() 2NO2的正反应速率v正=k1Cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
2NO2的正反应速率v正=k1Cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
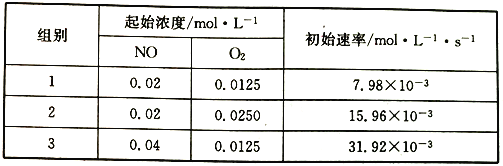
则k1=______________,m=______________,n=______________,
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2慢反应
2NO2慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是________(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如下变化。
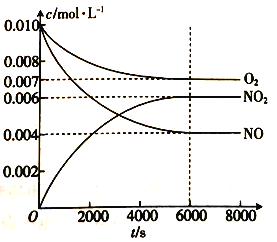
①NO的平衡转化率为 _______________。
②该温度下反应2NO(g)+O2(g)![]() 2NO2(g)的平衡常数为______________(保留整数)
2NO2(g)的平衡常数为______________(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. 己二酸电离常数Ka1(H2X)约为10-4.4
B. 曲线M表示pH与![]() 的变化关系
的变化关系
C. 当溶液中c(X2—)=c(HX—)时,溶液为碱性
D. 当混合溶液呈中性时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中的CO、NO、NO2、SO2都能使人中毒,其中易与人体中的血红蛋白结合,使血红蛋白失去运载O2能力的是( )
A. CO B. NO C. NO2 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
则x=___________。
化学键 | H-H | C-O | C三O | H-O | C-H |
E/(kJmol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
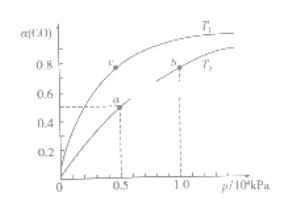
①T1_________T2(填“>”、“<”、“=”);a、b两点的反应速率:v(a)_____v(b)(填“>”、“<”、“=”);
在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是_____(填字母);
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
②计算图中a点的平衡常数KP=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
a:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
b:CO2(g)+H2(g)![]() CO(g)+H2O(g) H2
CO(g)+H2O(g) H2
c:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
①述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
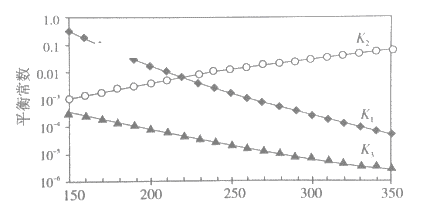
则H1__________H3(填“>”、“<”、“=”),理由是_______。
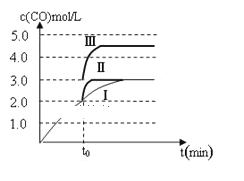
②一定温度下,在3 L容积可变的密闭容器中发生反应b,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_________。
③反应c的 △H___0, △S____0(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,断裂1molN≡N吸收942kJ热量.根据以上信息和数据,下列说法正确的是( )
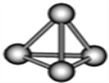
A. N4属于一种新型的化合物,与N2互为同素异形体
B. N4的沸点比白磷(P4)的高
C. 1mol N4转化为2mol N2的同时放出能量
D. 相同质量的N4和 N2所含原子个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com