
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
 +HNO3(浓)
+HNO3(浓)| 浓硫酸 |
| △ |
 +H2O,
+H2O, +HNO3(浓)
+HNO3(浓)| 浓硫酸 |
| △ |
 +H2O.
+H2O.


科目:高中化学 来源: 题型:
| A、2c(H2CO3)+c(HCO3-)+c(H+)═c(OH-) |
| B、c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C、c(Na+)>c(H+)>c(OH-)>c(CO32-) |
| D、c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
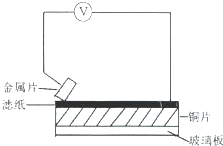 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A、Z金属可作为牺牲阳极保护法的阳极,保护Y金属 |
| B、Y金属不能从硫酸溶液中置换出氢气 |
| C、三种金属的活泼性顺序为:Z>X>Y |
| D、X和Y能构成电压最大的原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积∕mL | 消耗KMn04溶液体积∕mL |
| 1 | 25.00 | 19.98 |
| 2 | 25.00 | 19.12 |
| 3 | 25.00 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铝粉投入到NaOH溶液中:2Al+2OH-═2Al
| ||
| B、铁与盐酸反应:Fe+2H+═Fe3++H2↑ | ||
C、用小苏打治疗胃酸过多:H++HC
| ||
| D、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
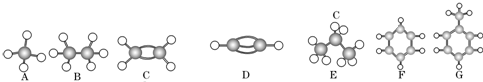
 复方冬青油软膏具有强力迅速镇痛作用.其有效成分的分子模型如图.下列说法中不正确的是( )
复方冬青油软膏具有强力迅速镇痛作用.其有效成分的分子模型如图.下列说法中不正确的是( )| A、该有机物中含氧元素的质量分数最小 |
| B、该有机物分子中氢、氧原子的个数比为8:3 |
| C、该有机物完全燃烧生成二氧化碳和水 |
| D、该有机物的化学式为C8H8O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
| B、25℃时等浓度的CH3COONa和NaCN溶液,后者pH大 |
| C、HCN溶液和NaOH溶液混合后一定存在:c(H+)-c(OH-)=c (CN-)-c(Na+) |
| D、常温下将pH相同的CH3COOH和HCN溶液稀释相同的倍数时,前者pH变化小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com