
【题目】向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。溶度积为Ksp=c(Ag+)·c(Cl-)=1×10-10,试求(写出简单计算过程):
(1)沉淀生成后溶液中c(Ag+)为_____。
(2)沉淀生成后溶液的pH是___。
【答案】10-7mol·L-1 2
【解析】
(1)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度;
(2)计算沉淀后溶液中氢离子浓度,再计算pH。
(1)50ml 0.02mol/L的盐酸中加入50ml 0.018mol/L AgNO3溶液加入后两者浓度分别为c(Ag+)=![]() =0.009 mol/L,c(Cl-)=
=0.009 mol/L,c(Cl-)=![]() =0.01mol/L,由Ag++Cl-=AgCl↓可知,Cl-过量,过量浓度c(Cl-)=0.01-0.009=0.001mol/L,Ksp=c(Ag+)×C(Cl-)=1.8×10-10,则:c(Ag+)=
=0.01mol/L,由Ag++Cl-=AgCl↓可知,Cl-过量,过量浓度c(Cl-)=0.01-0.009=0.001mol/L,Ksp=c(Ag+)×C(Cl-)=1.8×10-10,则:c(Ag+)=![]() =1.8×10-7(mol/L);
=1.8×10-7(mol/L);
(2)溶液中氢离子浓度=![]() 0.01mol/L,溶液pH=-lg0.01=2;
0.01mol/L,溶液pH=-lg0.01=2;
答案:10-7mol·L-1 2


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】为了进行氨的催化氧化实验:4NH3+5O2![]() 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
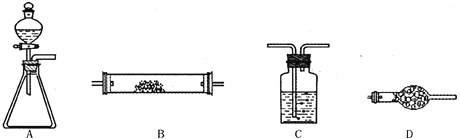
将所选的仪器按连接顺序由上至下依次填入下表(可不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) | 加入的试剂 | 作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,E为固体,F为有磁性的化合物。它们之间存在如下关系(反应中生成的水及次要产物均已略去):
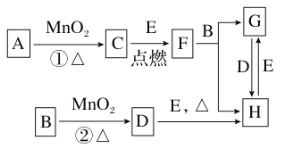
(1)写出下列物质的化学式:B________,E________。
(2)指出MnO2在相关反应中的作用:反应①中是________剂,反应②中是________剂。
(3)若反应①是在加热条件下进行,则A是________(填化学式);若反应①是在常温条件下进行,则A是________(填化学式);如在上述两种条件下得到等质量的C单质,反应中转移的电子数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研团队成功研究出高比能量、低成本的钠离子二次电池,其工作原理示意图如图。已知电池反应:Na1-xMnO2+NaxCn![]() NaMnO2+nC。下列说法正确的是( )
NaMnO2+nC。下列说法正确的是( )
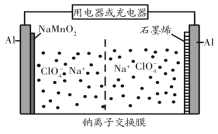
A.电池放电过程中,NaMnO2/Al上的电势低于石墨烯/Al上的电势
B.电池放电时,正极可发生反应Na1-xMnO2+xNa++xe-=NaMnO2
C.电池充电时,外接电源的负极连接NaMnO2/Al电极
D.电池充电时,Na+由NaMnO2/Al电极移向石墨烯/Al电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】打印机使用的墨粉中含有Fe3O4。它的一种制备方法是:将FeSO4溶液、Fe2(SO4)3溶液按一定比例混合,再加入一定量的NaOH溶液,水浴加热。反应如下:
反应a:![]()
下列分析不正确的是
A.Fe3O4具有磁性
B.反应a中,Fe2+ 是还原剂,Fe3+ 是氧化剂
C.从左至右,反应a各物质的系数依次为1、2、8、1、4
D.Fe3O4与盐酸反应,生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有相同电子层数的![]() 、
、![]() 、
、![]() 三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是
三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是![]() ,则下列判断正确的是( )
,则下列判断正确的是( )
A.原子半径:![]()
B.元素的非金属性:![]()
C.气体氢化物的稳定性:![]()
D.阴离子的还原性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如下。

已知:H3PO4能电离出PO43-。
(1)Li在元素周期表中的位置是________。
(2)LiFePO4中,铁元素的化合价为________价。
(3)将反应Ⅰ补充完整:____Fe2+ + 2H+ + ____H2O2 =____Fe3+ + 2H2O 。____
(4)反应Ⅲ的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL O2。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
A. 134.4mL B. 313.6mL C. 287.5mL D. 268.8mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中。
(1)________元素被氧化,________是氧化剂。
(2)________是氧化产物,________发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为_______。
(4)用双线桥法标明电子转移的方向和数目。____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com