
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;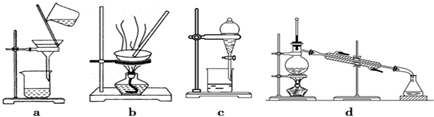
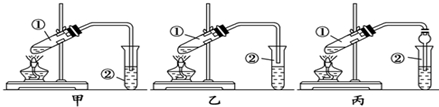
分析 (1)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,以及加热不充分也能产生倒吸进行解答;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应;用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;分离互不相溶的液体通常用分液的方法.
解答 解:(1)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,加热不充分也能产生倒吸,可用乙装置制取,防止倒吸回流现象的发生;丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝充分吸收产物乙酸乙酯作用外,球形干燥管球形部分由于容积较大,也能起到防止倒吸的作用,
故答案为:乙;既能防止倒吸,又能充分吸收产物乙酸乙酯;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以B、C正确,乙酸乙酯在上层,可用分液方法分离,需要用到的玻璃仪器主要是分液漏斗(可加烧杯),所以选择c装置,
CH3COOC2H5+H2O,乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以B、C正确,乙酸乙酯在上层,可用分液方法分离,需要用到的玻璃仪器主要是分液漏斗(可加烧杯),所以选择c装置,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;B、C;c.
CH3COOC2H5+H2O;B、C;c.
点评 本题考查乙酸乙酯的制备,题目难度中等,注意理解饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| 选 项 | A | B | C | D |
| 物 质 | MgCl2 | CO2 | HCl | NaOH |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | 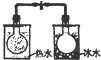 |
| 根据电流表(A)中指针是否偏转即可比较Zn,Cu的金属活泼性 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 | 根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲电极为阴极 | |
| B. | 为使电解产物全部转化为NH4NO3,需补充的物质为NH3 | |
| C. | 乙电极的电极反应式是:NO-3e-+4OH-=NO3-+2H2O | |
| D. | 该反应中NO既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2 | |
| C. | $\frac{1}{2}$C(s)+O2(g)=CO(g)△H1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | HCl(g)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H1; H2(g)+Cl2(g)=2HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com