
分析 根据激发态原子核外电子排布式确定该原子核外电子数,原子中核外电子数=原子序数,从而确定该元素,根据构造原理写出该元素基态原子核外电子排布式,在主族元素中,元素的最高化合价等于其族序数,从而确定其最高价氧化物对应的水化物.
解答 解:某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,该元素原子核外有16个电子,为S元素,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p4;其最高价氧化物对应水化物是硫酸,化学式为H2SO4,
故答案为:1s22s22p63s23p4;H2SO4.
点评 本题考查了原子核外电子排布式的书写、元素的确定、其最高价含氧酸的确定等知识点,正确推断元素是解本题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中分子间作用力越大,分子越稳定 | |
| B. | 二氧化硅的熔点、硬度均比二氧化碳高 | |
| C. | 冰融化时水分子时,仅共价键发生断裂,分子本身没有变化 | |
| D. | 氯化钠熔化时离子键被破坏,故属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
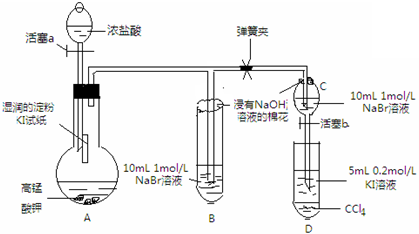
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
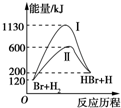
| A. | 反应热:过程Ⅰ>过程Ⅱ | |
| B. | 两个过程的反应热是相同的,△H=-80 kJ•mol-1 | |
| C. | 过程I中使用了催化剂 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4 L NO 和22.4 L O2混合后所得气体中分子总数为1.5 NA | |
| D. | 将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极发生还原反应 | |
| B. | 电解后,电解槽底部的阳极泥中只有Cu和Pt | |
| C. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| D. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 |
| A.证明Fe3+与SO2发生了氧化还原反应 | 将过量SO2通入FeCl3溶液中,然后将反应液加入酸性高锰酸钾溶液中,发现高锰酸钾溶液褪色 |
| B.除去CH3COOC2H5中的乙醇 | 加入适量CH3COOH,加热 |
| C.比较AgCl和AgI的 Ksp大小 | 向10mL浓度均为0.01mol/L的NaCl和KI混合溶液滴加少量0.01mol/L AgNO3溶液,观察现象 |
| D.比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH值,比较pH大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、有脂和蛋白质都能发生水解反应 | |
| B. | 乙烯、氯乙烯均可用于合成塑料 | |
| C. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| D. | 分子式为C6H14的有机物只有5种,它们属于同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com