
【题目】按要求用系统命法写出下列物质名称或结构简式
(1)用系统命法命名
① _________。
_________。
②  _________________。
_________________。
(2)顺-2-丁烯的结构简式为:____________。
(3)3-甲基-1-丁烯的结构简式为:_____________。
(4)2,2,3,3-四甲基戊烷的结构简式为:____________
(5)分子式为C5H10、核磁共振氢谱中只有一个峰的烃的结构简式_______;
【答案】3,3,6-三甲基辛烷 1,2,4-三甲(基)苯  (CH3)2CHCH=CH2
(CH3)2CHCH=CH2 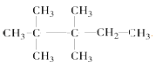
![]()
【解析】
(1)①根据系统命名法,最长的碳链为主链,主链有8个碳原子,从左端开始时,甲基所在位置的数目和最小,名称为3,3,6-三甲基辛烷;
②苯环上一取代基为起点,所在位置数目和最小,名称为1,2,4-三甲(基)苯;
(2)顺-2-丁烯为甲基在碳碳双键的同侧,且主链有4个碳原子,结构简式为 ;
;
(3)3-甲基-1-丁烯的起始端为含碳碳双键数目最小的一端,结构简式为(CH3)2CHCH=CH2;
(4)2,2,3,3-四甲基戊烷中第二、三个碳原子上各有2个甲基,主链上有5个碳原子的烷烃,结构简式![]() ;
;
(5)分子式为C5H10、核磁共振氢谱中只有一个峰,则10个氢原子完全相同,且其不饱和度为1,其结构简式为:![]() ;
;


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列情况会使所配溶液浓度偏低或其他测量值偏低的是( )
①用稀醋酸和稀氢氧化钠溶液反应测定中和热数值;②用滴定管量取液体时,开始时平视读数,结束时俯视读数所得溶液的体积;③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;④在用标准液(已知浓度)滴定未知溶液时,盛标准液的滴定管水洗后未润洗;⑤定容时,仰视容量瓶的刻度线
A. ①③⑤B. ①②⑤
C. ②③④D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如图1:
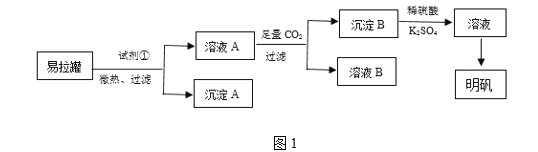
(1)试剂①应选用________(填代号)。
a.盐酸 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为__________。通入足量二氧化碳发生的反应的离子方程式___________________________。
(3)沉淀B为_____(填化学式),溶液B中溶质的主要成分为________(填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、________(填操作名称)、过滤、洗涤、干燥。如图2所示,蒸发操作中的一处错误是______________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为________。(已知:明矾的摩尔质量为474 g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v (PCl3) = 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3) = 0.11 mol·L-1,则反应的ΔH < 0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正) < v (逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl5,达到平衡时PCl5的转化率小于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作_______极(填“阴”或“阳”)。
(2)Se与S处于同一主族,比S原子多1个电子层,Se的原子序数为____________;其最高价氧化物的化学式为________;该族 2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+99.7 kJmol1 b.+29.7 kJmol1 c.-20.6 kJmol1 d.-241.8 kJmol1
表示生成 1 mol硒化氢反应热的是________________(填字母代号)。
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
① 请写出CuSe与浓H2SO4反应的化学方程式___________。
② 焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为_________。
③ 写出步骤ⅱ中的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应的化学方程式或离子方程式:
(1)Na和H2O反应的离子方程式___________________ ;
(2) Al2O3和NaOH反应的离子方程式___________________ ;
(3)Al和NaOH溶液反应的离子方程式___________________ ;
(4)Na2O2和CO2反应的化学方程式___________________ ;
(5) NaHCO3受热分解的化学方程式___________________ ;
(6)Fe与水蒸气在高温下反应化学方程式___________________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
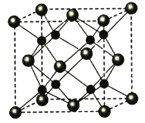
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种同体混合物,试回答下列问题:

(1)操作①的名称是___________,操作②的名称是__________________。
(2)试剂a是____________(填化学式,下同),固体B是____________。
(3)加入试剂b所发生反应的化学方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com