
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
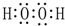 .
.分析 由元素在周期表中位置,可知J为氢、A为Na、B为钾、C为Mg、D为Al、E为碳、K为氮、I为磷、F为氧、G为Cl、H为Br、R为Ar.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;同周期自左而右金属性减弱、同主族自上而下金属性增强;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;J与F按原子个数1:1所成的化合物为H2O2;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多,离子半径越大;
(4)元素非金属性越强,对应氢化物越稳定;氨气分子之间存在氢键,沸点较高;
(5)氯气与氢氧化钠反应生成NaCl、NaClO,NaClO具有漂白性;
(6)金属性越强,阳离子氧化性越弱;
(7)1mol物质完全燃烧生成稳定物质放出的热量为燃烧热,注明物质的聚集状态与反应热,书写热化学方程式.
解答 解:由元素在周期表中位置,可知J为氢、A为Na、B为钾、C为Mg、D为Al、E为碳、K为氮、I为磷、F为氧、G为Cl、H为Br、R为Ar.
(1)同稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中K的金属性最强,故答案为:Ar;K;
(2)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,J与F按原子个数1:1所成的化合物为H2O2,电子式为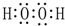 ,故答案为:NaOH;
,故答案为:NaOH;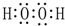 ;
;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多,离子半径越大,故离子半径:K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(4)非金属性Cl>Br,元素非金属性越强,对应氢化物越稳定,故稳定性HCl>HBr;氨气分子之间存在氢键,沸点高于PH3,故答案为:稳定;NH3;氨气分子之间存在氢键;
(5)氯气与氢氧化钠反应生成NaCl、NaClO,NaClO具有漂白性,含有离子键、共价键,故答案为:NaClO;离子键、共价键;
(6)金属性:Na>Mg>Al,金属性越强,阳离子氧化性越弱,故离子氧化性:Al3+>Mg2+>Na+,故答案为:Al3+;Mg2+;Na+;
(7)1g元素氢气完全燃烧生成液态氧化物时放出的热量为142.9KJ,则1mol氢气燃烧放出的热量为142.9kJ×$\frac{1mol×2g/mol}{1g}$=285.8kJ,故氢气燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
点评 本题考查元素周期表与元素周期律的综合应用,比较基础,注意对元素周期表的整体把握.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含有离子键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 含有离子键的化合物一定属于离子化合物 | |
| D. | 含共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| B. | 根据Ksp(CaCO3)<Ksp(CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4,使之转化为疏松、易溶于酸的CaCO3 | |
| C. | 常温下,将醋酸稀溶液加水稀释,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 已知反应:3H2(g)+WO3(s)=W(s)+3H2O(g)只有在高温时才能自发进行,则它的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
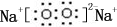 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 | |
| B. | 反应前5秒钟内,用CO表示的平均反应速率为0.04 mol•L-1•s-1 | |
| C. | 当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 | |
| D. | 保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 由苯制溴苯;CH4制CH2Cl2 | |
| D. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用木材作燃料 | B. | 用乙醇替代汽油 | C. | 开发风能 | D. | 开发地热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com