
肼是重要的化工原料。某探究小组利用下
列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一: 制备NaClO溶液。(实验装置如右图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。
(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓
度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实
验方案。 。
实验二: 制取水合肼。(实验装置如右图所示)控制反应温度,将分液漏斗中溶液缓慢滴入
三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)

(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
【知识点】有化学实验方案设计与评价
【答案解析】 (1) B、D (2) Cl2+ 2NaOH = NaClO + NaCl + H2O
(3) 取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.100mol·L-1盐酸滴定,重复上述操作2~3次
(4) B 如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化
(5) NaHCO3会与滴定过程中产生的HI反应 (6) 9%
解析:(1)配制溶液需要在烧杯内进行,需要用量筒量取水,用玻璃棒搅拌,还用到胶头滴管,所以选择BD;(2)Cl2与NaOH溶液发生反应时,生成氯化钠、次氯酸钠和水。所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;(3)取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后(加双氧水的目的是除去溶液中的次氯酸跟离子),滴加2~3滴酚酞试液,用 0.100mol·L-1盐酸滴定,重复上述操作2~3次 。(4)分液漏斗中的溶液是NaOH和NaClO混合溶液,因为如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化。(5)NaHCO3会与滴定过程中产生的HI反应,所以可以控制溶液的pH值。(6)根据方程式I2 的物质的量是0.1x18x10-3=1.8x10-3mol,水合肼的物质的量是0.9x10-3mol,其质量为0.045g因为只取用了原溶液的十分之一,所以质量分数为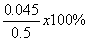 =9%
=9%
【思路点拨】本题考查实验方案的设计与评价,比如实验仪器的选择,滴定实验中的除杂,还有题,考查学生综合分析问题的能力、提取信息的能力等方面,难度中等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
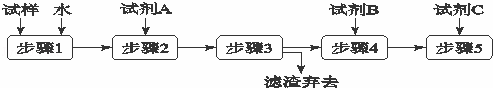
某同学设计了以下流程来检验碳酸钾粉末中含有少量氯化钾和氢氧化钾.下列说法不正确的是( )
|
| A. | 步骤3的操作名称是过滤 |
|
| B. | 步骤1所需玻璃仪器是烧杯和玻璃棒 |
|
| C. | 试剂A是BaCl2溶液 |
|
| D. | 加入试剂A 的目的是除去CO32﹣并避免对Cl﹣或OH﹣的检验的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
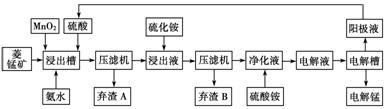
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中实验操作能达到实验目的的是
| 实验操作 | 实验目的 | |
| A | 将乙醇滴加到酸性KMnO4或K2Cr2O7溶液中 | 证明乙醇具有氧化性 |
| B | 向苯酚的饱和溶液中滴加稀溴水 | 制备三溴苯酚 |
| C | 向乙醚和苯酚的混合液中加入金属钠 | 确定乙醚中混有苯酚 |
| D | 将氯水加入浸泡过海带灰的溶液中 | 使溶液酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据实验目的判断下列实验操作或装置正确的是
| 目的 | A.检验火柴头燃烧 产生的SO2 | B.配制稀硫酸 溶液 | C.分离Cl2与KBr 反应生成的Br2 | D.检查装置 气密性 |
| 装置 或 操作 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如下图所示。

已知: 由E二聚得到
由E二聚得到
完成下列填空:
(1)A的名称是________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式______________________________________。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式: _________________________________________ ____________________________。
____________________________。
鉴别这两个环状化合物的试剂为__________________________________________。
(4)以下是由A制备工程塑料PB的原料之一1,4丁二醇(BDO)的合成路线:

写出上述由A制备BDO的化学反应方程式:
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某芳香族化合物A的分子中含有C、H、O、N四种元素,现以苯为原料合成A,并最终制得F(一种
染料中间体),转化关系如下(一些非主要产物已略去):


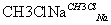
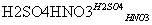
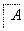
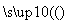
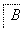
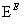
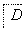
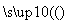 F(
F(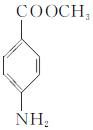 )
)
已知:Ⅰ.R —Cl+2Na+Cl—R1—→R—R1+2NaCl(R、R1为烃基)
—Cl+2Na+Cl—R1—→R—R1+2NaCl(R、R1为烃基)
Ⅱ. 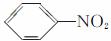
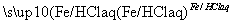
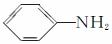 苯胺(弱碱性,易被氧化)
苯胺(弱碱性,易被氧化)
(1)写出A的结构简式:_________________________________________。
(2)下列有关说法中正确的是________(填序号)。
①由苯制M、由N制A、由B制D的反应都是取代反应
②E分子中的所有原子在同一平面上
③试剂Ⅰ是酸性高锰酸钾溶液,试剂Ⅱ是Fe/HCl(aq)
④试剂Ⅰ和试剂Ⅱ可以对调
⑤F具有两性
(3)写出由B制D的化学方程式:_______________________________________
______________________________________________ __________________。
__________________。
(4)写出同时满足下列要求的D的同分异构体的结构简式:________________
________________________________________________________。
①属于芳香族化合物,分子中有两个互为对位的取代基,其中一个取代基是硝基;
②分子中含有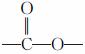 结构;
结构;
③1 mol该有机物与NaOH溶液完全反应,能够消耗2 mol NaOH。
(5)F的水解反应如下: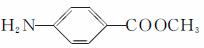
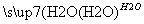
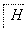 +
+ ,化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、航空等领域。请写出该缩聚反应的化学方程式:____________________________。
,化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、航空等领域。请写出该缩聚反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中各微粒的浓度关系错误的是 ( )
A.0.1 mol·L-1 CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+)
B.0.1 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO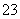 )+c(OH-)
)+c(OH-)
C.25℃时,有等浓度的①NH4HSO4溶液、②NH4HCO3溶液中c(NH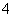 ):①>②
):①>②
D.含等物质的量的NaX和弱酸(HX)混合溶液中一定存在:c(Na+)>c(X-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com