
【题目】(CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)写出K2表达式:____。
(2)推导反应CO2(气)+H2(气)![]() CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:__,判断该反应是__反应(填“吸热”或“放热”)。
CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:__,判断该反应是__反应(填“吸热”或“放热”)。
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2(气),在1173K时发生反应CO2(气)+H2(气)![]() CO(气)+H2O(气)并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
CO(气)+H2O(气)并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.2740 | 0.0260 | 0.0260 | |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_____。
②在0~5min之间,达平衡时CO2的转化率为____。
③第6min时,平衡向____方向(填“正反应”或“逆反应”)移动,可能的原因是___。
【答案】c(H2)/c(H2O) K1/K2 吸热 0.0130mol/(L·min) 63.65% 正反应 移走水蒸气或者升高温度
【解析】
本题应从化学平衡常数的定义、影响因素等知识入手进行分析;
(1)根据化学平衡常数的定义,K2=c(H2)/c(H2O);
(2)根据化学平衡常数的定义,K1=c(CO)/c(CO2),K2=c(H2)/c(H2O),K=c(CO)×c(H2O)/[c(CO2)×c(H2)],因此K=K1/K2;根据表中数据,K1随着温度的升高而增大, K2随着温度升高而降低,因此K随着温度升高而增大,即正反应为吸热反应;
(3)①根据化学反应速率的数学表达式,v(CO)= 0.0260mol·L-1/2min=0.0130mol/(L·min);
②CO2的转化率为(0.2000-0.0727)mol·L-1/0.2000mol·L-1×100%=63.65%;
③对比第5min和6min的浓度,得出反应物的浓度减小,生成物浓度增大,即反应向正反应方向进行,根据题中所给数据,浓度的变化与化学反应方程式系数成正比例关系,因此改变的因素有可能是移走水蒸气或者升高温度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.滴加少量![]() 溶液可以加快Zn与稀
溶液可以加快Zn与稀![]() 反应的速率
反应的速率
B.高压比常压更有利于![]() 转化为
转化为![]()
C.蒸干![]() 溶液无法得到无水
溶液无法得到无水![]()
D.新制氯水长时间放置颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物相对分子质量为17;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)Z元素原子的 L层电子数为______,元素 Y的原子结构示意图___________,T的一种核素在考古时常用来鉴定一些文物的年代,用的核素是___________(填核素符号)。
(2)元素Q与V可以形成18电子化合物的其电子式为_________,元素W与Q形成的化合物的类型_____________(填‘离子化合物’或‘共价化合物’)。
(3)V的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是___________。
(4)写出X、W 两种元素最高价氧化物对应的水化物相互反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
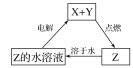
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 __________mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则方程式中CO2和N2的化学计量数之比为______。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
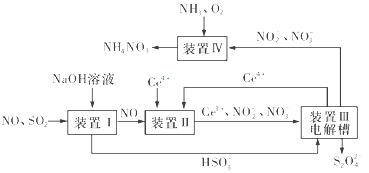
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载 | 化学知识 | |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄.硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________。
(3)B单质在A单质中燃烧,生成物的化学式为___________。
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于____。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______,写出有关化学反应方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com