
| A. | 原子半径:A<B | B. | 原子序数:A>B | ||
| C. | 原子最外层电子数:B>A | D. | 元素所在的周期数:A>B |
分析 A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期,原子序数A较大,核外电子排布相同的离子,核原子序数越大,离子半径越小,所以B离子半径较大,以此解答该题.
解答 解:A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期.
A.A元素形成阳离子与B元素形成阴离子,A元素处于B元素相邻的下一周期,电子层越多,原子半径越大原子半径A>B,故A错误;
B.A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期,原子序数A较大,即原子序数A>B,故B正确;
C.A元素易形成阳离子,则A原子的最外层电子数小于4,B元素易形成阴离子,则B原子的最外层电子数大于4,所以原子最外层电子数:B>A,故C正确;
D.A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期,则元素所在的周期数:A>B,故D正确;
故选:A.
点评 本题考查结构与位置关系,为高频考点,侧重学生的分析能力的考查,难度中等,关键根据离子的电子层结构推断元素的位置关系.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 168O、178O、188O属于同位素 | |
| B. | N60和N2互为同系物 | |
| C. | O2和O3、H2和D2、H218O和H216O都互为同素异形体 | |
| D. | CH2O2、C2H4O2、C3H6O2、C4H8O2互为同系物;乙二醇、丙三醇也互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
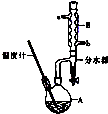 B正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
B正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.819 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑧ | B. | ④⑤⑦⑧ | C. | ③④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

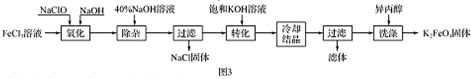
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冬季居民的家中用煤取暖 | B. | 城市和乡村大力开展植树造林 | ||
| C. | 工厂排放烟尘的烟囱加高 | D. | 将城市的固体废弃物运向农村倾倒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示. 关于该电池的叙述不正确的是( )
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示. 关于该电池的叙述不正确的是( )| A. | 该电池不能在高温下工作 | |
| B. | 电池右侧电极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放电过程中,H+通过质子交换膜向电池右侧迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成CO2 22.4 L(标况) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com