
| A. | 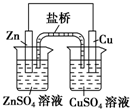 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 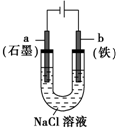 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 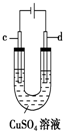 用装置精炼铜时,c极为粗铜 | |
| D. | 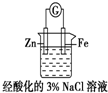 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
分析 A.装置为原电池,阳离子向正极移动;
B.Fe与电源正极相连,失去电子,阴极氢离子放电;
C.装置精炼铜时,粗铜应为阳极;
D.Zn为负极,电子由负极流向正极.
解答 解:A.装置为原电池,阳离子向正极移动,则K+移向CuSO4溶液,故A错误;
B.Fe与电源正极相连,失去电子,阴极氢离子放电,则装置通电一段时间后溶液中氢氧化亚铁被氧化生成红褐色物质,故B正确;
C.装置精炼铜时,粗铜应为阳极,则d极为粗铜,故C错误;
D.Zn为负极,电子由负极流向正极,装置中电子由Zn电极沿外电路流向Fe电极,而Fe不失去电子,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握电化学反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )
如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )| ①Cu为阳极,Zn为阴极 ②Cu极上有气泡产生 ③SO42-向Cu极移动 ④若有0.5mol电子流经导线,可产生0.25mol气体 ⑤电子的流向是Cu→导线→Zn ⑥正极反应式:Cu+2e-═Cu2+ |
| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
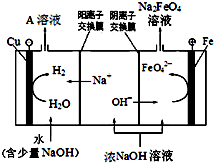 铁及其化合物在生产生活中具有重要的作用.
铁及其化合物在生产生活中具有重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L | B. | 3mol/L | C. | 4mol/L | D. | 5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com