分析:A.氯化镁是离子化合物,由镁离子与氯离子构成,镁离子电子数为其离子符号,氯离子最外层有8个电子,其电子式应用[]括起,并在右上角注明电荷;
B.最外层电子数不能超过8;
C.根据8电子稳定结构,C原子成4个键、O原子成2个键、Cl原子成1个键,COCl2中C原子与O原子之间形成2对共用电子对,C原子与Cl原子之间形成1对共用电子对;
D.丙烯中C=C双键中其中1个碳碳键断裂,自身发生加成反应生成聚丙烯,选项中链节的主链错误.
解答:解:A.氯化镁是离子化合物,由镁离子与氯离子构成,其电子式为
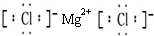
,故A错误;
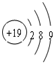
B.K原子核外有19个电子,其原子结构示意图为
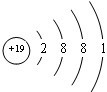
,故B错误;
C.根据8电子稳定结构,C原子成4个键、O原子成2个键、Cl原子成1个键,COCl
2中C原子与O原子之间形成2对共用电子对,C原子与Cl原子之间形成1对共用电子对,其结构式为
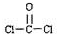
,故C正确;
D.丙烯中C=C双键中其中1个碳碳键断裂,发生加聚反应生成聚丙烯,聚丙烯结构简式为
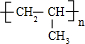
,故D错误,
故选C.
点评:本题考查常用化学用语的书写,难度中等,注意掌握常用化学用语书写原则,D选项中高聚物结构简式书写注意化学键成键位置.

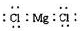
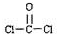
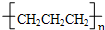
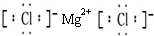 ,故A错误;
,故A错误; ,故B错误;
,故B错误;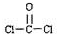 ,故C正确;
,故C正确;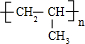 ,故D错误,
,故D错误,

 一线名师权威作业本系列答案
一线名师权威作业本系列答案