
分析 (1)氧化铝是两性氧化物溶于强酸强碱;
(2)因铝热反应是铝和金属氧化反应得到金属和氧化铝;
(3)石英玻璃的主要成分是SiO2,酸性氧化物与碱反应生成盐和水;
(4)根据制备水泥和玻璃的原料分析;
解答 解:(1)氧化铝是两性氧化物和强酸强碱反应,氧化铝与氢氧化钠溶液作用生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O;故答案为:Al2O3+2OH-═2AlO2-+H2O;
(2)因铝热反应是铝和金属氧化反应得到金属和氧化铝,化学方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3;
(3)石英玻璃的主要成分是SiO2,酸性氧化物与碱反应生成盐和水,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,故答案为:SiO2;SiO2+2OH-═SiO32-+H2O;(4)制备水泥的原料是粘土、石灰石;制备玻璃的原料是纯碱、石灰石、石英,所以都用到CaCO3,故答案为:CaCO3.
点评 本题考查了几种常见的材料,同时涉及Al和二氧化硅的性质,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
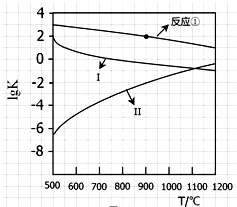 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 没有氧元素参加的反应一定不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属氟化物的晶格能顺序是LiF>NaF>KF>RbF>CsF;则钠的卤化物的晶格能顺序是NaF>NaCl>NaBr>NaI | |
| B. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序是AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 若盐酸的浓度是醋酸浓度的2倍;则盐酸中H+浓度也是醋酸中H+浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+O2(气)═CO2(气)△H1 C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$ Cl2(气)═HCl(气)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com