
| A. | 1 mol碳完全燃烧放出的热大于110.5 kJ | |
| B. | ①的焓变为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液完全反应生成1 mol水时放热为57.3 kJ | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、焓变分吸收热量,放出热量;
C、浓硫酸溶解放热;
D、醋酸为弱电解质,电离过程为吸热过程.
解答 解:A、在101kPa时,1mol可燃物完全燃烧生成稳定氧化物时所放出的热量.使用燃烧热时要注意两个关键点:①反应物用量:可燃物为1mol;②产物要求:充分燃烧成稳定氧化物[H→H2O(l)、C→CO2 (g)、S→SO2 (g)],该反应没有生成稳定氧化物,因此碳的燃烧热比此处反应热的绝对值大,故A正确;
B、①的焓变为-221kJ/mol,故B错误;
C、浓硫酸溶解放热,所以浓硫酸与稀NaOH溶液完全反应生成1 mol水时放热大于57.3 kJ,故C错误;
D.醋酸为弱电解质,电离过程为吸热过程,则稀醋酸与稀NaOH溶液反应生成lmol水,放出的热量小于57.3kJ,故D错误.
故选A.
点评 本题考查燃烧热和中和热的理解,题目难度不大,注意中和热的表示方法.


科目:高中化学 来源: 题型:选择题
| A. | 氯化钠和氯化铯晶体中,阳离子的配位数均为6 | |
| B. | 金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键 | |
| C. | 金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8 | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 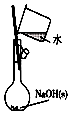 用于配制0.10 mol•L-1 NaOH溶液;评价:正确 | |
| B. |  用于测定中和热;评价:错误,装置中缺少了环形玻璃搅拌棒 | |
| C. | 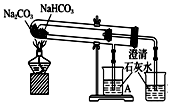 用于比较Na2CO3、NaHCO3的热稳定性;评价:正确 | |
| D. | 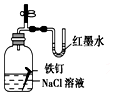 证明铁发生吸氧腐蚀时空气参加反应;评价:正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①②④ | C. | ②④⑥ | D. | ②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明 Cl2的氧化性强于 I2 | |
| B. | 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明 Cl2 有漂白性 | |
| C. | 向氯水中滴加硝酸酸化的 AgNO 溶液,产生白色沉淀,说明氯水中含有 Cl- | |
| D. | 向氯水中加入 NaHCO 粉末,有气泡产生,说明氯水中含有 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 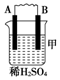 |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应②的化学反应速率,提高CH3OCH3产率 | |
| B. | 反应③使用催化剂,△H3减少 | |
| C. | 反应 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.lkJ•mol-1 | |
| D. | 反应③对反应②无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
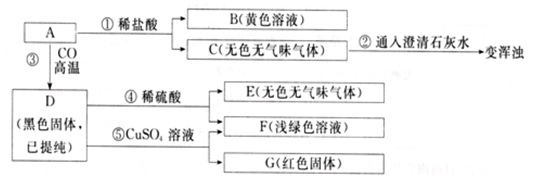
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com