
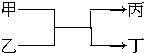
 若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 碳和镁 | B. | 氟气和氧气 | C. | 碳和氢气 | D. | 氧气和硫 |
分析 甲、乙为短周期不同主族元素组成的单质,乙、丁为氧化物,则该反应是单质和氧化物发生的置换反应,符合甲+丙→乙+丁的置换反应且甲和乙为短周期不同主族的元素形成的单质即可,以此来解答.
解答 解:A.镁和碳是短周期的不同主族元素,发生的反应可以是:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,故A选;
B.F、O为短周期不同主族元素,发生氟气与水的反应生成HF和氧气,但HF不是氧化物,故B不选;
C.C、H均为短周期不同主族元素,发生C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,故C选;
D.O、S为同主族元素,发生硫化氢与氧气的置换反应,故D不选;
故选AC.
点评 本题考查无机物的推断,为高频考点,把握元素化合物知识、物质性质及转化、元素在周期表的位置等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1L0.1 mol/L氨水中含有0.1NA NH3分子 | |
| B. | 46gNO2和N2O4混合气体中含有的原子数为3NA | |
| C. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| D. | 常温常压下,12g 14C所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
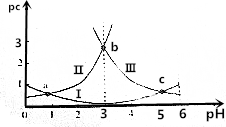
| A. | 曲线Ⅰ表示H2C2O4的变化 | |
| B. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| C. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等 | |
| D. | 常温下,$\frac{c({H}_{2}{C}_{2}{O}_{4})•c({C}_{2}{{O}_{4}}^{2-})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$随pH的升高先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
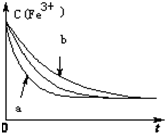 已知下列反应:
已知下列反应:| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L•s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
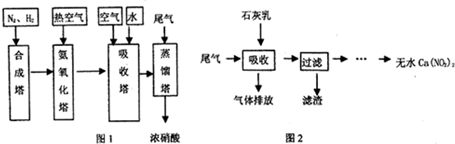
 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甲酸甲酯(HCOOCH3)和乙酸(CH3COOH) | D. | 淀粉和纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该粒子不显电性 | |
| B. | 该粒子的质量数与${\;}_{z}^{4}$He的相同,两者互为同位素 | |
| C. | 在元素周期表中与氢元素占同一位置 | |
| D. | 1mol该粒子的质量为8g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在如图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体.
在如图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com