
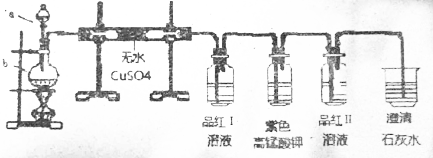
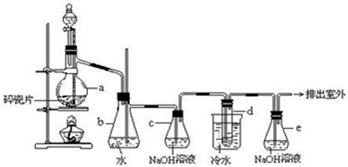
分析 木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水;验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水;再验证二氧化硫,能使品红试液褪色,再用高锰酸钾除去二氧化硫,并除净后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳,据此回答即可.
解答 解:木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水;验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水;再验证二氧化硫,能使品红试液褪色,再用高锰酸钾除去二氧化硫,并除净后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳.
(1)a仪器名称是分液漏斗,b仪器名称是圆底烧瓶,红热的炭与浓硫酸反应的化学方程式为:C+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+H2O,故答案为:分液漏斗;圆底烧瓶;C+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+H2O;
(2)①验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水;故答案为:变蓝;H2O;
②高锰酸钾能将二氧化硫氧化,但是和二氧化碳不反应,可以用高锰酸钾除去二氧化硫,现象是高锰酸钾褪色,故答案为:褪色;吸收二氧化硫;
③品红Ⅱ用来检验二氧化硫是否除尽,气体通过品红,无现象,说明二氧化硫已被充分吸收,故答案为:无现象;二氧化硫已被充分吸收;
④用澄清石灰验证二氧化碳,二氧化碳能使石灰水变浑浊,故答案为:变浑浊;CO2.
点评 本题考查了浓硫酸性质及其应用,题目难度中等,注意掌握二氧化硫、二氧化碳的性质及检验方法,明确检验顺序为解答关键,试题培养了学生的分析能力及化学实验能力.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | △H<0且△S>0的反应肯定是不自发的 | B. | △H<0且△S<0的反应肯定是自发的 | ||
| C. | △H>0且△S>0的反应肯定是自发的 | D. | △H<0且△S>0的反应肯定是自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 53g碳酸钠中含NA个CO32- | |
| D. | 同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
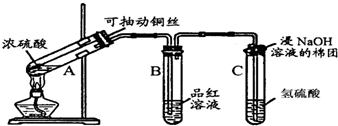
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
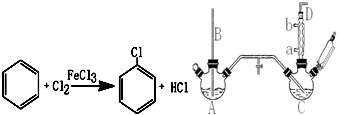
| 名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
| 苯 | 78 | 78 | 0.88 |
| 氯苯 | 112.5 | 132.2 | 1.1 |
| 邻二氯苯 | 147 | 180.4 | 1.3 |

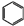 +2HCl+O2$→_{210℃}^{催化剂}$2
+2HCl+O2$→_{210℃}^{催化剂}$2 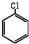 +2 H2O.
+2 H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶中加水未到刻度线 | |
| B. | 所用NaOH已经潮解 | |
| C. | 有少量NaOH溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com