


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源:不详 题型:单选题
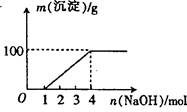
| A.②⑤⑥⑦ | B.②③⑤⑦ |
| C.①②③⑥⑦ | D.①②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) | 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 溶液。 | 现象: 结论:假设1不成立。 |
| 步骤2: | 现象: 结论:假设2成立。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
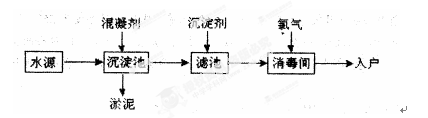
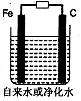
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素: |
B.用醋酸除去水垢: |
C.苯酚钠溶液中通入少量 |
D.实验室用液溴和苯在催化剂作用下制溴苯: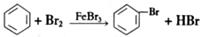 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4] 2+ |
| C.向反应后的溶液中加入乙醇,溶液没有发生变化 |
| D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 BaSO4↓+2NH3↑+2H2O,请回答:
BaSO4↓+2NH3↑+2H2O,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com