
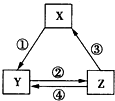
 下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )| 选项 | X | Y | Z |
| A | Mg | MgO | MgCl2 |
| B | Fe | FeCl3 | FeCl2 |
| C | Na2CO3 | NaOH | NaHCO3 |
| D | Cl2 | Ca(ClO)2 | HClO |
| A. | A | B. | B | C. | C | D. | D |
分析 A.MgCl2不能一步生成MgO;
B.Fe与氯气反应生成氯化铁,氯化铁与Fe反应生成氯化亚铁,氯化亚铁与锌反应生成Fe;
C.Na2CO3与Ca(OH)2反应生成NaOH,NaOH与二氧化碳反应生成NaHCO3,NaHCO3与过量Ca(OH)2溶液生成NaOH,NaHCO3加热分解生成Na2CO3;
D.Cl2可与Ca(OH)2反应生成Ca(ClO)2,Ca(ClO)2与酸反应生成HClO,HClO与浓盐酸反应生成Cl2.
解答 解:A.MgCl2不能一步生成MgO,MgCl2与NaOH反应生成氢氧化镁,氢氧化镁受热分解生成MgO,故A错误;
B.Fe与氯气反应生成氯化铁,氯化铁与Fe反应生成氯化亚铁,氯化亚铁与锌反应生成Fe,各组物质之间通过一步反应能实现如图所示转化关系,故B正确;
C.Na2CO3与Ca(OH)2反应生成NaOH,NaOH与二氧化碳反应生成NaHCO3,NaHCO3与过量Ca(OH)2溶液生成NaOH,NaHCO3加热分解生成Na2CO3,故C正确;
D.Cl2可与Ca(OH)2反应生成Ca(ClO)2,Ca(ClO)2与酸反应生成HClO,HClO与浓盐酸反应生成Cl2,可一步转化,故D正确.
故选A.
点评 本题考查了元素化合物的性质,题目难度不大,侧重对学生基础知识的检验和训练,同时坚固对学生能力的培养,有利于激发学生的学习积极性,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
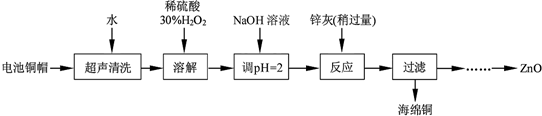
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.01mol•L-1Ba(OH)2溶液中:Na+、NH4+、NO3-、HCO3- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Fe2+、NO-3、Cl- | |
| C. | 含有苯酚的溶液中:K+、Cl-、Br-、Fe3+ | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、I-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p(Ne)>p(N2)>p(O2) | B. | p(O2)>p(Ne)>p(N2) | C. | p(N2)>p(O2)>p(Ne) | D. | p(N2)>p(Ne)>p(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 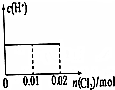 | B. |  | C. | 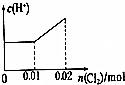 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 错误观点 | “否定的”离子方程式 | |
| ① | 所有的离子方程式均可以表示一类化学反应 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ② | 所有酸碱中和反应均可表示为 H++OH-═H2O | 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子沿外电路从锌电极流向铜电极 | |
| C. | 氮氧燃料电池工作时,氮气在负极被氧化 | |
| D. | 原电池中一定发生了氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com