
| A. | 溴乙烷的电子式 | |
| B. | 向溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| C. | 溴乙烷与KOH溶液反应:CH3CH2Br+H2O$→_{△}^{KOH}$C2H5OH+KBr | |
| D. | 用溴乙烷制取乙二醇经过以下几步:消去→加成→水解 |
分析 A.溴乙烷中溴原子还有3个孤电子对;
B.溴乙烷中不存在自由移动的溴离子,应该先让溴乙烷发生水解反应或消去反应,然后在利用硝酸酸化的硝酸银溶液检验溴离子;
C.溴乙烷和氢氧化钾的水溶液加热发生取代反应生成乙醇,反应方程式不遵循元素守恒;
D.用溴乙烷制取乙二醇时,溴乙烷先发生消去反应、再发生加成反应、最后发生取代反应或水解反应.
解答 解:A.溴乙烷中溴原子还有3个孤电子对,溴乙烷电子式为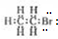 ,故A错误;
,故A错误;
B.溴乙烷中不存在自由移动的溴离子,所以溴乙烷中直接滴加硝酸银溶液不产生淡黄色沉淀,溴元素检验方法是:将溴乙烷和NaOH的水溶液或醇溶液混合加热,然后向溶液中滴加稀硝酸中和未反应的NaOH,最后滴加硝酸银溶液,根据是否产生淡黄色沉淀判断是否含有溴元素,故B错误;
C.溴乙烷和氢氧化钾的水溶液加热发生取代反应生成乙醇,反应方程式不遵循元素守恒,其方程式为CH3CH2Br+KOH$\stackrel{H_{2}O}{→}$C2H5OH+KBr,故C错误;
D.用溴乙烷制取乙二醇时,制取步骤为溴乙烷$→_{△}^{NaOH的醇溶液}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷$→_{△}^{NaOH的水溶液}$乙二醇,发生的反应为消去→加成→水解,故D正确;
故选D.
点评 本题以溴乙烷为载体考查物质制备、元素检验、电子式的书写、方程式的书写等知识点,明确官能团及其性质关系、常见反应类型等知识点即可解答,难点是D选项中路线设计,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中溶质的质量分数为ω=$\frac{100a(M-18n)}{a+b}$% | |
| B. | 该溶液的物质的量浓度为c=$\frac{1000a}{MV}$mol•L-1 | |
| C. | 该溶液中溶剂与溶质的质量比为m(水):m(溶质)=($\frac{18na}{M}+b$):(a-$\frac{18na}{M}$) | |
| D. | 该溶液的密度为ρ=$\frac{1000(a+b)}{V}$g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
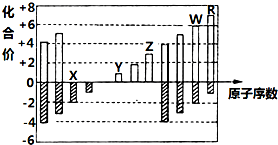 如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )| A. | 原子半径比较:Z>Y>X | |
| B. | 最高价氧化物对应的水化物的酸性比较:W>R | |
| C. | X和Y形成的化合物中只含离子键 | |
| D. | Z的氧化物和Y的 最高价氧化物对应的水化物能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.如图1是北京鸟巢试放烟火奥运五环图,并回答下列问题:
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.如图1是北京鸟巢试放烟火奥运五环图,并回答下列问题: ,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:A>B>C>D | B. | 最外层电子数:A>B>C>D | ||
| C. | 单质氧化性:C>D | D. | 非金属性:A>B>C>D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com