
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 恰好完全反应时,溶液不易导电,所以BaSO4和水都是非电解质 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
分析 往氢氧化钡溶液中滴加硫酸至过量,发生反应生成硫酸钡和水,溶液的离子浓度先减小后增大,溶液的导电性与溶液的离子浓度大小有关,离子浓度越大,则溶液导电性越强,灯泡越亮,反之越暗.
解答 解:A.溶液的导电性与溶液中离子的浓度有关,故A正确;
B.由于溶液体积未知,离子的物质的量多但离子浓度不一定大,故B错误;
C.硫酸钡和水都是电解质,但硫酸钡溶解度较小,水电离程度较小,所以恰好完全反应时,溶液不易导电,故C错误;
D.往氢氧化钡溶液中滴加硫酸至过量,会生成难溶的硫酸钡和难电离的水,所以导电性会先减弱,硫酸过量之后,导电性又增强,所以,灯泡的明亮度变化是:明→暗→明,而往氢氧化钡溶液中滴加盐酸,生成的是易溶易电离的氯化钡,所以溶液导电能力一直很强,灯泡一直明亮,故D错误.
故选A.
点评 本题考查电解质溶液的导电性,题目难度不大,注意把握溶液导电性与离子浓度的关系,注意把握溶液中的离子反应,为解答该题的关键.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
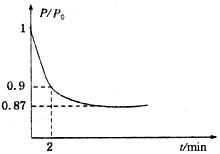 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
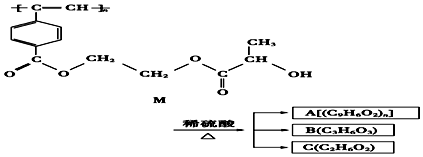
| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应 | |
| C. | 1molM与热的烧碱溶液反应,可消耗2nmol的NaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸 | |
| B. | 制蒸馏水时,应使温度计水银球雄近蒸馆烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用敞口容器称量NaOH且时间过长 | |
| B. | 定容时俯视读取刻度 | |
| C. | 原容量瓶洗净后未干燥 | |
| D. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,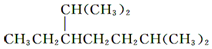 的名称为2,6二甲基5乙基庚烷 的名称为2,6二甲基5乙基庚烷 | |
| B. | 丙氨酸和甘氨酸脱水,最多可生成4种二肽 | |
| C. | 化合物 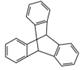 是芳香族化合物 是芳香族化合物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com