
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
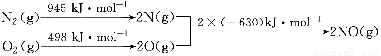
写出该反应的热化学方程式:________________。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)=CH3OH(g)ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g)ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________。
根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________。
(1)N2(g)+O2(g)=2NO(g)ΔH=+183 kJ/mol;
(2)2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g);ΔH=-204.7 kJ/mol
一是使平衡向右移动,从而提高二甲醚的产率;二是使反应物浓度增大,有利于提高反应速率。
【解析】(1)ΔH=945 kJ/mol+498 kJ/mol-2×630 kJ/mol=+183 kJ/mol;
(2)CO与H2反应直接得到二甲醚的反应方程式为2CO+4H2―→H2O+CH3OCH3,由2×(ⅰ)+(ⅳ)即可得到此反应的热化学方程式:2CO(g)+4H2(g)=H2O(g)+CH3OCH3(g) ΔH=-204.7 kJ·mol-1。增大压强对本反应的影响表现在两个方面:一是使平衡向右移动,从而提高二甲醚的产率;二是使反应物浓度增大,有利于提高反应速率。


科目:高中化学 来源: 题型:
| ||
| 催化剂 |
| ||
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
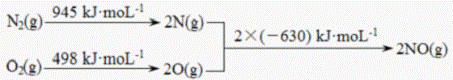
写出该反应的热化学方程式:______ ks5u
(2)已知CO和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)= H2O(l) △H=-44kJ/mol,ks5u
写出CO与水蒸气反应生成 CO2和H2的热化学方程式______
(3)某温度下在容积固定的密闭容器中,反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)达到平衡,起始所放反应物的物质的量之比与其转化率如下表:
CO2(g)+H2(g)达到平衡,起始所放反应物的物质的量之比与其转化率如下表:
| n(CO):n(H2O) | CO转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
①该反应的平衡常数为______ 。该温度下,向容器中充入1molCO、3mol H2O、2mol CO2、1.5molH2,则起始时该反应速率V正_____ V逆(填“>”、“<”或“=”)
②结合表中数据判断下列说法中正确的是______ _
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的之比为1:4时,M的转化率为0.85
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com