
【题目】某化学兴趣小组用如图所示的装置做有关CO2气体的实验:

⑴甲同学将收集满CO2气体的试管倒插入紫色石蕊试液中(左图),并轻轻振荡试管。
①描述产生的现象:____________________________________________。
②写出反应的化学方程式:____________________________________________。
⑵乙同学挤压图装置中滴管的胶头,使其中的NaOH溶液滴入烧瓶,并轻轻振荡,系在导气管一端的气球慢慢胀大。产生这一现象的原因是________________________(请用离子方程式结合必要的文字说明)。
【答案】水槽中的溶液进入试管内形成一段液柱,试管内溶液变浅红色 CO2+H2O=H2CO3 CO2+2OH-=CO32―+H2O,CO2减少,使烧瓶内压强减小,所以空气会经玻璃导管进入气球,从而使气球慢慢胀大
【解析】
⑴二氧化碳和水反应,水槽中的溶液慢慢进入到试管中,由于反应生成了碳酸,碳酸使紫色石蕊变红。
⑵氢氧化钠和二氧化碳反应,烧瓶中二氧化碳量减少,压强减小,因此系在导气管一端的气球慢慢胀大。
⑴①二氧化碳和水反应,水槽中的溶液慢慢进入到试管中,由于反应生成了碳酸,碳酸使紫色石蕊变红,因此产生的现象为水槽中的溶液进入试管内形成一段液柱,试管内溶液变浅红色,故答案为:水槽中的溶液进入试管内形成一段液柱,试管内溶液变浅红色。
②写出反应的化学方程式:CO2+H2O=H2CO3,故答案为:CO2+H2O=H2CO3。
⑵NaOH溶液滴入烧瓶,并轻轻振荡,氢氧化钠和二氧化碳反应,烧瓶中二氧化碳量减少,压强减小,因此系在导气管一端的气球慢慢胀大。产生这一现象的原因是CO2+2OH-=CO32-+H2O,CO2减少,使烧瓶内压强减小,所以空气会经玻璃导管进入气球,从而使气球慢慢胀大,故答案为:CO2+2OH-=CO32-+H2O,CO2减少,使烧瓶内压强减小,所以空气会经玻璃导管进入气球,从而使气球慢慢胀大。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
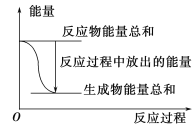
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
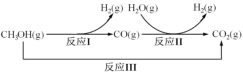
(1)已知一定条件下
反应I:CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
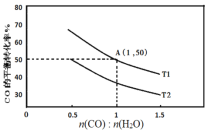
①比较T1、T2的大小,T1___T2(填“>”“<”或“=”)。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)___v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)CO2在生产中有着广泛的用途。
①将过量CO2通入KOH溶液中可生成KHCO3,请写出该反应的离子方程式___。
②在经CO2饱和处理的KHCO3弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。该电极为___(填“阴极”或“阳极”),电极反应式是___。
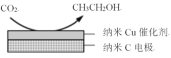
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,下列热化学方程式书写正确的是( )
A. 1/2Ba(OH)2(aq)+1/2H2SO4(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
B. 1/2KOH(aq)+H2SO4(aq)![]() 1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 2NaOH(aq)+H2SO4(aq)![]() Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
D. KOH(aq)+1/2H2SO4(浓)![]() 1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯氧化法处理CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
⑴某厂废水中含KCN(N为-3价,KOCN也是),其浓度为650mg·L-1。现用氯碱法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是_______。
⑵投入过量的液氯,可以将氰酸盐进一步氧化为N2,化学方程式为2KOCN+4KOH+3Cl2=N2↑+2CO2↑+6KCl+2H2O,若处理上述废水20L,使KCN完全转化为无毒物质,计算需要液氯的质量。___________若将所需液氯换成氯气,则所需氯气在标准状况下的体积为多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-![]() 2As+3
2As+3![]() +6M关于该反应的说法中正确的组合是
+6M关于该反应的说法中正确的组合是
①氧化剂是H3AsO3
②还原性:As>SnCl2
③每生成1molAs,反应中转移电子的物质的量为3mol
④M为OH-
⑤![]() 是氧化产物
是氧化产物
A.①②④⑤B.①③⑤C.①②③④D.只有①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:

活性炭的作用是_______;O3消毒的优点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用质量分数为36.5%的浓盐酸(密度为1.25 g·mL-1),配制240 mL 0.1mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为__________。
(2)配制240 mL 0.1 mol·L-1的盐酸,应量取浓盐酸体积__________mL。
(3)应选用容量瓶的规格__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com