
【题目】浩瀚的海洋中蕴藏着丰富的资源。
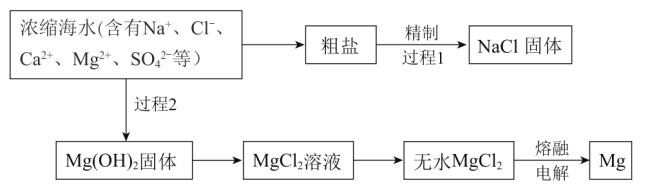
(1)粗盐精制。
过程1除去粗盐中的Ca2+、Mg2+、![]() 杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液,过滤除去沉淀,再加入适量的盐酸。
杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液,过滤除去沉淀,再加入适量的盐酸。
①加入沉淀剂的顺序正确的是______(填序号)。
A.abc B.bac C.cba
②加入适量盐酸,反应的离子方程式有2H++![]() =H2O+CO2↑和______。
=H2O+CO2↑和______。
(2)海水提镁。
过程2中加入的试剂是______。由无水MgCl2获得Mg的化学方程式是______。
(3)海水提溴。
主要工业生产流程如图所示:
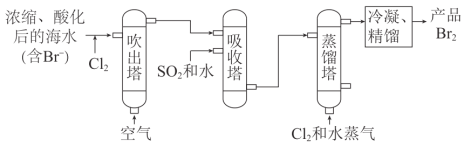
①海水中的Br-被Cl2氧化的离子方程式是______。
②吸收塔中SO2将Br2转化为HBr的化学方程式是______。
③工业上也可用Na2CO3溶液吸收吹出的Br2。补全以下化学方程式:___Br2+___Na2CO3+3H2O![]() ___NaBr+___NaBrO3+___NaHCO3,____________
___NaBr+___NaBrO3+___NaHCO3,____________
【答案】BC H++OH-=H2O CaO ![]() 2Br-+Cl2= Br2+2Cl- SO2+Br2+2H2O=H2SO4+2HBr 3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3
2Br-+Cl2= Br2+2Cl- SO2+Br2+2H2O=H2SO4+2HBr 3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3
【解析】
(1)①粗盐精制过程1除去粗盐中的Ca2+、Mg2+、![]() 杂质时,加入过量的Na2CO3溶液的目的是除去Ca2+的同时除去过量的Ba2+;
杂质时,加入过量的Na2CO3溶液的目的是除去Ca2+的同时除去过量的Ba2+;
②加入适量盐酸,剩余的碳酸钠和盐酸反应、剩余的氢氧化钠和盐酸反应;
(2)过程2中氢氧化钙和氯化镁反应生成氢氧化镁沉淀。电解熔融的MgCl2生成Mg和氯气;
(3)①海水中的Br-被Cl2氧化为溴单质;
②吸收塔中SO2和Br2反应生成HBr和硫酸;;
③根据得失电子守恒、元素守恒配平Na2CO3溶液吸收吹出的Br2的化学方程式;
(1)①粗盐精制过程1,加入Na2CO3除去Ca2+、加入NaOH溶液除去Mg2+、加入BaCl2溶液除去![]() ,加入过量的Na2CO3溶液的目的是除去Ca2+的同时除去过量的Ba2+;所以加入BaCl2溶液后再加Na2CO3溶液,加入试剂的顺序是NaOH溶液、BaCl2溶液、Na2CO3溶液,或BaCl2溶液、Na2CO3溶液、NaOH溶液,选BC;
,加入过量的Na2CO3溶液的目的是除去Ca2+的同时除去过量的Ba2+;所以加入BaCl2溶液后再加Na2CO3溶液,加入试剂的顺序是NaOH溶液、BaCl2溶液、Na2CO3溶液,或BaCl2溶液、Na2CO3溶液、NaOH溶液,选BC;
②加入适量盐酸,剩余的碳酸钠和盐酸反应2H++![]() =H2O+CO2↑、剩余的氢氧化钠和盐酸反应H++OH-=H2O;
=H2O+CO2↑、剩余的氢氧化钠和盐酸反应H++OH-=H2O;
(2)过程2中加入CaO, CaO和水反应生成氢氧化钙,氢氧化钙和氯化镁反应生成氢氧化镁沉淀,加入的试剂是CaO。电解熔融的MgCl2生成Mg和氯气,反应方程式是![]() ;
;
(3)①海水中的Br-被Cl2氧化为溴单质,反应的离子方程式是2Br-+Cl2= Br2+2Cl-;
②吸收塔中SO2和Br2反应生成HBr和硫酸,化学方程式是SO2+Br2+2H2O=H2SO4+2HBr;
③根据得失电子守恒、元素守恒配平Na2CO3溶液吸收吹出的Br2的化学方程式;3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
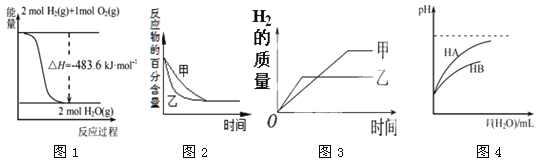
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是
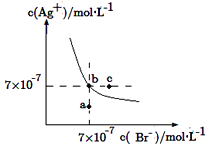
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,金属离子(Mn+)浓度的负对数值随溶液pH变化关系如图所示[已知:pM=-lgc(Mn+),且假设c(Mn+)≤10-6mol/L认为该金属离子已沉淀完全]。根据判断下列说法正确的是( )
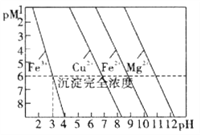
A. 常温下,Ksp[Mg(OH)2]<Ksp[Fe(OH)2]
B. 可以通过调节溶液pH的方法分步沉淀Cu2+和Fe2+
C. 除去Cu2+中少量Fe3+,可控制溶液3≤pH<4
D. pM与Ksp之间的关系式为:pM=lgKsp- nlgc(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业在工农业生产、生活中有着重要作用。反应原理为:3H2(g)+N2(g)![]() 2NH3(g) △H < 0。
2NH3(g) △H < 0。
(1)在T ℃时,将一定物质的量的H2和N2置于一容积不变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是__________(填序号)。
a.容器内的压强不再随时间变化
b.3υ(N2)=υ(H2)
c.3υ正(H2)=2υ逆(NH3)
d.混合气体的密度保持不变
②达上述平衡后,其他条件不变,升高温度,υ逆___________________(填“增大”、“不变”、“减小”),υ正和υ逆的关系为υ正___________υ逆(填:“>”、“=”、“<”),最后二者相等。
③该条件下达到平衡时,向容器内充入惰性气体,增大容器内的压强,NH3的体积分数将(填:“变大”、“不变”或“变小”)。________
(2)在T ℃时,将一定物质的量的H2和N2置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可能是______。
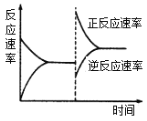
a.升高温度,同时加压b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)在T ℃时,将0.6 mol H2和0.4 mol N2置于容积为2 L的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3 (g) △H <0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强(MPa)随时间变化如图所示:8 min内NH3的平均生成速率为_______。
2NH3 (g) △H <0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强(MPa)随时间变化如图所示:8 min内NH3的平均生成速率为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 0.1mo1·L-1NH4HS溶液中有:c(NH4+)<c(HS-)+c(S2-)+c(H2S)
B. 25℃时,将a mo1·L-1的氨水与0.01 mo1·L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3·H2O的电离常数为![]()
C. 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN)
D. 等pH的HA和HB溶液,分别与一定浓度的氢氧化钠溶液完全中和,HA消耗的氢氧化钠溶液体积多,则可证明酸性HA<HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH![]() 数目增多 ④c(OH-)增大 ⑤导电性增强
数目增多 ④c(OH-)增大 ⑤导电性增强
A.①②③ B.①③⑤ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的流程如下:
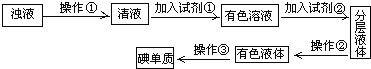
(1)指出过程中有关的实验操作①和②名称:①_______,②_______。
(2)下列物质中,能使湿润的KI-淀粉试纸变蓝的是________。
A.碘蒸气 B.Cl2 C.KI溶液 D.饱和氯化钠溶液
(3)试剂①若用氯水,请写出发生反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是
A. 将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液
B. 将少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液
C. 将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2(g)
D. 将少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入过量NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com